Einzelmolekülfluoreszenzspektroskopie
Die Einzelmolekülfluoreszenzspektroskopie (englisch Single Molecule Fluorescence Spectroscopy) ist eine Methode der physikalischen Chemie, um einzelne Moleküle sichtbar zu machen. In der Regel wird ein Konfokalmikroskop oder ein TIRF-Mikroskop verwendet, welches es erlaubt, die Größe des Detektionsvolumens auf unter einen Femtoliter (10−15 Liter) zu begrenzen. Dadurch wird erreicht, dass sich bei geeigneter Verdünnung der zu untersuchenden Moleküle im Durchschnitt weniger als ein fluoreszenzaktives Molekül im Fokus befindet. Nach Anregung durch einen geeigneten Laser werden vom angeregten Molekül Photonen emittiert (Fluoreszenz), die zur Charakterisierung der Eigenschaften individueller Moleküle herangezogen werden können. Bei Ensemblemessungen befinden sich dagegen mehrere Moleküle im Beobachtungsvolumen, sodass die Einzelmoleküleigenschaften verborgen bleiben und nur ein Mittelwert detektiert wird.
Ensemble- vs. Einzelmolekülmessungen
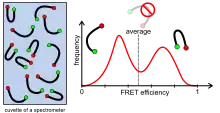
Ensemblemessungen (z. B. in einem Fluoreszenz- oder Absorptionsspektrometer) ergeben immer einen Mittelwert über die gesamte Probe gemittelt. Dieser kann aber eine Probe vortäuschen, die in Wirklichkeit nicht vorhanden ist, weil z. B. der Mittelwert über zwei unterschiedliche Spezies in der Probe denselben Wert ergibt.
Ein Beispiel: Misst man während einer Ensemblemessung die gesamte Fluoreszenzintensität einer Probe mit zum Beispiel zehn fluoreszenzaktiven Molekülen, so erhält man einen bestimmten zeitlichen Mittelwert. Dieser verbirgt jedoch, dass von den zehn Molekülen eventuell sechs nur schwach fluoreszieren und die anderen vier den Hauptteil der gemessenen Fluoreszenzintensität ausmachen. Dasselbe ist in der Abbildung rechts für eine FRET-Messung dargestellt. Die Probe besteht aus zwei unterschiedlichen Konformationen, die entweder einen hohen oder einen niedrigen FRET ergeben. Eine Mittelung über beide würde einen mittleren FRET ergeben, nach dem man auf eine dritte Konformation, die tatsächlich aber gar nicht vorliegt, schließen würde.
Vorgehen bei der Messung
Diffusionsmessungen oder flussgetriebene Messungen
Die zu untersuchenden Moleküle werden in einer Pufferlösung so verdünnt in das Mikroskop eingebracht, dass die Wahrscheinlichkeit zwei fluoreszierende Moleküle gleichzeitig im Beobachtungsvolumen anzutreffen verschwindend gering wird. Während einer dann folgenden längeren Messung (typisch 10–60 min) diffundieren nacheinander einzelne Moleküle durch das Beobachtungsvolumen, deren Fluoreszenzsignal jeweils als burst detektiert wird. Aus den Eigenschaften des Bursts lassen sich dann Eigenschaften des Moleküls bestimmen. Dazu kann Einzelmolekülfluoreszenzspektroskopie mit verschiedenen anderen Verfahren kombiniert werden:
- Förster-Resonanz-Energie-Transfer (dann oft als single molecule FRET oder smFRET bezeichnet) erlaubt es Abstände innerhalb eines Moleküls und deren Änderung zu vermessen.[1]
- Polarisationsaufgelöste Detektion: Diese erlaubt es z. B. die Fluoreszenzanisotropie eines Moleküls und damit Aussagen über seine Rotationsdiffusion zu bestimmen.[2]
- Fluoreszenz-Korrelations-Spektroskopie kann auch auf einzelne Bursts angewendet werden. Diese Methode erlaubt es Diffusionskonstanten und Reaktionskinetiken zu vermessen.[3]
- Fluoreszenzlebensdauermessungen helfen verschiedene molekulare Spezies zu trennen.[4]
- magnetische und optische Pinzetten können eingesetzt werden, um einzelne Moleküle zu fangen und Kräfte auf sie auszuwirken.[5]
Als Erweiterung erlauben es Methoden der Mikrofluidik die Bedingungen während einer Messung (Temperatur, Puffer, Chemie) einfach zu beeinflussen und zu steuern[6]. Ferner kann die Verweildauer einzelner Moleküle im Fokus durch Erhöhung der Probenviskosität oder durch Immobilisierung der Moleküle an Oberflächen (siehe nächster Abschnitt) erweitert werden. Auch der Einschluss einzelner Moleküle in (immobilisierten) Vesikeln wurde bereits gezeigt.[7]
Messungen an immobilisierten Molekülen
Im Gegensatz zu den bisher beschriebenen Messungen können Moleküle auch fest an Oberflächen gebunden werden. Diese werden dann z. B. mit einem TIRF-Mikroskop über längere Zeitspannen untersucht. So lässt sich z. B. die Photophysik (Blinken, Bleichen) von Farbstoffen[8] oder auch die Dynamik von einzelnen Molekülen mittels FRET vermessen[9].
Single Particle Tracking (SPT)
Die SPT-Technik (dt. seltener auch Einzelpartikelverfolgung genannt) kann ebenfalls grob zur Klasse der Einzelmolekülfluoreszenzspektroskopie gezählt werden. Hier werden einzelne, fluoreszenzmarkierte Teilchen (Quantenpunkte, markierte Proteine, …) über längere Zeiten mit Hilfe eines Mikroskops verfolgt. Aus den dabei gemessenen Trajektorien kann auf die Diffusionseigenschaften der Teilchen und auf den Aufbau ihrer Umgebung geschlossen werden.
Literatur
- C. Gell, A. Smith, D. Brockwell: Handbook of Single Molecule Fluorescence Spectroscopy. Oxford Univ. Press, 2006, ISBN 978-0-19-852942-2
- Chirlmin Joo, Hamza Balci, Yuji Ishitsuka, Chittanon Buranachai, Taekjip Ha: Advances in Single-Molecule Fluorescence Methods for Molecular Biology. In: Annual Review of Biochemistry. Band 77, Nr. 1, Juni 2008, ISSN 0066-4154, S. 51–76, doi:10.1146/annurev.biochem.77.070606.101543.
Weblinks
- Tutorials zum Prinzip der Messung und den Anforderungen an die Moleküle. ssm.uni-bayreuth.de
Einzelnachweise
- T. Ha, T. Enderle, D. F. Ogletree, D. S. Chemla, P. R. Selvin, S. Weiss: Probing the interaction between two single molecules: fluorescence resonance energy transfer between a single donor and a single acceptor. In: Proceedings of the National Academy of Sciences. Band 93, Nr. 13, 25. Juni 1996, ISSN 0027-8424, S. 6264–6268, doi:10.1073/pnas.93.13.6264.
- C. Eggeling, S. Berger, L. Brand, J. R. Fries, J. Schaffer, A. Volkmer, C. A. Seidel: Data registration and selective single-molecule analysis using multi-parameter fluorescence detection. In: Journal of Biotechnology. Band 86, Nummer 3, April 2001, S. 163–180, ISSN 0168-1656. PMID 11257530.
- Ted A. Laurence, Youngeun Kwon, Eric Yin, Christopher W. Hollars, Julio A. Camarero, Daniel Barsky: Correlation Spectroscopy of Minor Fluorescent Species: Signal Purification and Distribution Analysis. In: Biophysical Journal. Band 92, Nr. 6, März 2007, ISSN 0006-3495, S. 2184–2198, doi:10.1529/biophysj.106.093591.
- Stanislav Kalinin, Alessandro Valeri, Matthew Antonik, Suren Felekyan, Claus A. M. Seidel: Detection of Structural Dynamics by FRET: A Photon Distribution and Fluorescence Lifetime Analysis of Systems with Multiple States. In: The Journal of Physical Chemistry B. Band 114, Nr. 23, 17. Juni 2010, ISSN 1520-6106, S. 7983–7995, doi:10.1021/jp102156t.
- I. Rasnik: Unraveling helicase mechanisms one molecule at a time. In: Nucleic Acids Research. Band 34, Nr. 15, 25. August 2006, ISSN 0305-1048, S. 4225–4231, doi:10.1093/nar/gkl452.
- Bin Wang, Joseph Ho, Jingyi Fei, Ruben L. Gonzalez Jr., Qiao Lin: A microfluidic approach for investigating the temperature dependence of biomolecular activity with single-molecule resolution. In: Lab on a Chip. Band 11, Nr. 2, 2011, ISSN 1473-0197, S. 274, doi:10.1039/c0lc00157k.
- I. Cisse, B. Okumus, C. Joo, T. Ha: Single-molecule Chemistry and Biology Special Feature: Fueling protein DNA interactions inside porous nanocontainers. In: Proceedings of the National Academy of Sciences. Band 104, Nr. 31, 11. Mai 2007, ISSN 0027-8424, S. 12646–12650, doi:10.1073/pnas.0610673104.
- B. Lounis, J. Deich, F. I. Rosell, Steven G. Boxer, W. E. Moerner: Photophysics of Red, a Red Fluorescent Protein, from the Ensemble to the Single-Molecule Level. In: The Journal of Physical Chemistry B. Band 105, Nr. 21, Mai 2001, ISSN 1520-6106, S. 5048–5054, doi:10.1021/jp010116x.
- J. A. Lamboy, H. Kim, K. S. Lee, T. Ha, E. A. Komives: Visualization of the nanospring dynamics of the I B ankyrin repeat domain in real time. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 25, 21. Juni 2011, ISSN 0027-8424, S. 10178–10183, doi:10.1073/pnas.1102226108.