Salmonella-Virus P22
Salmonella-Virus P22 (wissenschaftlich Salmonella virus P22, veraltet: Enterobacteria phage P22, Phage P22) ist ein Bakteriophage (Bakterienvirus) aus der Gattung Lederbergvirus (früher P22virus, P22likevirus, P22-like viruses, P22-like phages) in der Familie Podoviridae. Seine Wirte sind Salmonellen vom Serotyp Typhimurium (wissenschaftlich Salmonella enterica subsp. enterica ser. Typhimurium).[2] Wie viele andere Bakteriophagen wird es in der Molekularbiologie verwendet, um Mutationen in kultivierten Bakterien zu induzieren und fremdes genetisches Material einzuführen[3] P22 wurde bei der generalisierten Transduktion eingesetzt und ist ein wichtiges Instrument zur Untersuchung der Genetik von Salmonellen.[2]
| Salmonella-Virus P22 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Salmonella virus P22 | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| P22 | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Aufbau und Systematik
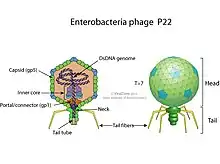
P22 ist in der Genetik und Wirkungsweise dem Bakteriophagen λ (Escherichia-Virus Lambda) sehr ähnlich.[2] Das Genom von P22 besteht wie bei Lambda aus doppelsträngiger DNA[4] Allerdings unterscheiden sich die Gene, die für den Aufbau des Virions (Virusteilchens) kodieren von denen des Lambda-Phagen.[4]
Der Kopf der P22-Virionen hat eine ikosaedrische Symmetrie mit einer Triangulationszahl T=7, sein Durchmesser beträgt 60 nm. Daran befindet sich ein kurzer Schwanz, was ihn als Mitglied der Familie der Podoviridae ausweist.[4]
Das Schwanzprotein (englisch tailspike protein) von P22 ist in der Virushülle verankert und dient dazu, das Eindringen in die Membran der Wirtszellen zu ermöglichen. Der Tailspike von P22 (gp9 genannt) hat eine ungewöhnliche Beta-Helix-Faltung.
Der Bakteriophage E34 (alias Salmonella-Phage 34[5] bzw. Bacteriophage ε34[6]) gilt heute als Variante von P22 innerhalb der Spezies Salmonella-Virus P22.[4][5]
Traditionell wurde P22 mit Viren ähnlicher Kurzschwanz-Morphologie, Genom-Transkription und Vermehrungszyklen in Verbindung gebracht, insbesondere mit dem Lambda-Phagen und anderen lambdoiden Phagen (Phagen der Gattung Lambdavirus, früher auch englisch Lambda-like phages, Lambda-like viruses, Lambdalikevirus genannt). Heute gilt diese Verwandtschaft jedoch als überbewertet und die Gattung Lambdavirus wird jetzt in eine andere Phagenfamilie Siphoviridae innerhalb der Ordnung Caudovirales der geschwänzten Viren gestellt.[7]
Auch der Bacillus-Phage Phi29 (Φ29, Spezies Bacillus-Virus phi29) hat eine Morphologie ähnlich wie der Lambda-Phage, aber im Genom ebenfalls nur wenig Übereinstimmung mit P22.[4] Φ29 wird daher heute ebenfalls (als Spezies) in eine weitere eigenständige Familie Podoviridae innerhalb der Ordnung Caudovirales gestellt.[8]
Das NCBI führt aktuell folgende Viren in der Spezies Salmonella-Virus P22:[9]
- Salmonella-Phage 22
- Salmonella-Phage 25
- Salmonella-Phage 34
- Salmonella-Phage P22-pbi
Genom
Die Virusteilchen (Virionen) von P22 besitzen ein einzelnes doppelsträngiges DNA-Molekül (dsDNA), d. h. ein unsegmentiertes Genom (monopartit). Seine Länge beträgt etwa 44 kbp (Kilobasenpaare).[4] Das Genom von P22 wurde 2006 sequenziert, dabei wurden 65 Gene identifiziert.[2] Die Genomlänge des „Wildtyps“ von P22 beträgt jedoch nur etwa 42 kbp.[4] Die Ergebnisse der Sequenzierung stützen die Hypothese, dass P22 ein mosaikartig zusammengesetztes Genom hat, und durch umfassende Rekombination mit dem anderen Viren entstanden ist.[2]
Die Forschung an P22 hat sich lange auf die Unterschiede zum Bakteriophagen λ konzentriert, insbesondere was die Mechanismen angeht, wie die DNA bei einer Infektion weitergereicht wird und wie sie in den Virionen verpackt ist.[4]
Αus den per Rolling-Circle-DNA-Replikation erzeugten DNA-Molekülen wird zunächst ein so genanntes Concatamer gebildet. Dieses beinhaltet eine Verdopplung von etwa 4 % der DNA-Sequenz an beiden Enden. D. h. Am Ende des DNA-Strangs hängt noch ein kurzes Stück vom Anfang, und umgekehrt.[4] Das Kapsid des Phagenkopfes hat nämlich mehr Platz, als für exakt 100 % der DNA-Sequenz benötigt werden.[10][4] Dies wird als headful packaging bezeichnet, da die replizierte DNA in den Phagenkopf des Virions ‚gestopft‘ wird, bis dieser voll ist, anstatt jedes Virion mit einer exakten 1:1-Kopie der DNA-Sequenz zu füllen.[11][12][4] Insgesamt befinden sich im Virion dann normalerweise 48 kbp.
Da die im Kapsid verpackte DNA linear ist, muss sie nach der Infektion des Wirtsbakteriums für die Rolling-Circle-DNA-Replikation zirkularisiert, d. h. ringförmig geschlossen werden. Dies geschieht durch eine homologe Rekombination zwischen den direkten Wiederholungen an den beiden sich überlappenden Enden des noch linearen DNA-Strangs.[4] Die dafür nötigen Rekombinationsenzyme sind entweder Ergebnisse der Translation des sie kodierenden wirtseigenen rec-Gens. Im den Fall, dass diese nicht verfügbar sind, bringt P22 aber ersatzweise auch eigene solche Rekombinationsfunktionsgene mit.[13][4] Die resultierende zirkuläre DNA, mit der Kopie der P22-Nukleotidsequenz ist das Substrat (Ausgangsmaterial) für die Genexpression und DNA-Replikation.[4]
Vermehrungszyklus
Infektion
Die Infektion beginnt, wenn der Schwanz des P22-Phagen an das O-Antigen-Lipopolysaccharid auf der Oberfläche der Salmonellen vom Serotyp Typhimurium bindet.[2] Das Schwanzfaserprotein des Virions hat die Funktion einer Endorhamnosidase, die die O-Antigen-Kette spaltet.[4] Nach einer Infektion kann P22 entweder in einen lytischen oder einen lysogenen Wachstumspfad eintreten.[2]
- Auf dem lytischen Pfad beginnt die Virusreplikation unmittelbar nach der Infektion und setzt innerhalb einer Stunde etwa 300–500 Phagennachkommen per Zelllyse frei.[2]
- Auf dem lysogenen Pfad integriert sich die Phagen-DNA jedoch in das Wirtsgenom und wird durch Zellteilung an Tochterzellen weitergegeben (temperenter Phage).[2]
Der Hauptfaktor, der den Wachstumspfad steuert, ist die Vielzahl der Infektionen (englisch multiplicity of infection, moi); ein hoher moi-Wert begünstigt den lysogenen Pfad, ein niedriger den lytischen.[2]
Assemblierung
Im Zug der Assemblierung (des Zusammenbaus der Virusteilchen) baut P22 wie andere große dsDNA-Viren zuerst eine „Procapsid“-Struktur auf und packt dann das DNA-Genom hinein.[4] Das P22-Procapsid ist aus einem gut untersuchten Protein (Hüllprotein, englisch coat protein) zusammengesetzt: Während des Zusammenbaus sind etwa 250 Moleküle eines Gerüstproteins (englisch scaffolding protein) im Procapsid vorhanden. Dieses wird mit Fortschreiten der DNA-Verpackung wieder freigesetzt. Das freigesetzte Gerüstprotein wird nicht beschädigt und kann sich mit neu synthetisiertem Hüllprotein wieder zusammensetzen, um mehr Procapside zu bilden. Seine Funktion ist daher tatsächlich die eines Gerüsts. Da es die Assemblierung anderer Proteine vermittelt, ohne Teil der fertigen Struktur zu werden, wirkt per Definition katalytisch. Bei Laborinfektionen nehmen Gerüstproteinmoleküle durchschnittlich an 5 Runden der Procapsid-Assemblierung teil.[4]
Das Mitwirken eines Gerüstproteins an der Assemblierung des Procapsids ist auch bei anderen großen Viren mit ikosaedrischer Gestalt üblich, beispielsweise bei den Eukaryoten infizierenden Herpesviren. Allerdings wird in einigen Fällen das Gerüst proteolytisch entfernt, anstatt wiederverwendet zu werden.[4]
Im Übrigen unterdrückt das P22-Gerüstprotein seine eigene Synthese, solange keine Procapside mit seiner Hilfe zusammengesetzt werden. Dies ist eines der wenigen bekannten Beispiele, wo die Synthese eines Virion-Strukturproteins durch den Assemblierungsprozess moduliert (beeinflusst) wird.[4]
Für die Stabilisierung der in den P22-Phagenkapsiden kondensierten DNA werden die vermöge dreier Gene erzeugten Proteine benötigt: Gp4, Gp10 und Gp26.[14] Diese Proteine verstopfen die Öffnung, durch die die DNA eindringt.[15] Diese drei Proteine scheinen an die neu gefüllten Kapside zu polymerisieren und bilden so den Hals des reifen Phagen, durch den später bei der Infektion die DNA in die Wirtszelle injiziert wird. Gp4 (englisch tail accessory factor ‚Schwanzzubehörfaktor‘ von P22) wird als erstes den gerade mit DNA befüllten Kapsiden angeheftet. In Lösung wirkt das Protein als Monomer und weist eine geringe strukturelle Stabilität auf. Beim Zusammenbau des Schwanzes werden zwei nicht gleichartige Sätze mit sechs gp4-Monomeren angelagert. Gp4 fungiert als Strukturadapter für gp10 und gp26, den beiden anderen Bestandteilen (‚Zubehörfaktoren‘) des Schwanzes.[16]
Anwendung in der Salmonellengenetik
Die Transduktion (Genübertragung zwischen Bakterien durch Viren) wird in der Bakterien ausgiebig eingesetzt und ist bei der gentechnischen Erzeugung neuer Stämme (englisch strains) nützlich.[17] Im Allgemeinen erfordert die Transduktion innerhalb jeder Bakterienart (Spezies) die Verwendung eines spezifischen Phagen, da die meisten Phagen ein sehr eng umrissenes Wirtsspektrum aufweisen. Beispielsweise wird P22 zur Transduktion in den Serotyp Salmonella enterica sv. Typhimurium eingesetzt.[17] P22 ist insbesondere lagerstabil, Bestände mit hohem Titer sind leicht zu erhalten und es wurden Mutanten mit Hochfrequenztransduktion (englisch high-frequency transduction, HT) isoliert.[17]
Einzelnachweise
- ICTV: ICTV Taxonomy history: Enterobacteria phage T4, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Peter E. Prevelige Jr.; Richard Lane Calendar (Hrsg.): The Bacteriophages, 2.. Auflage, Oxford University Press, New York, New York 2006, ISBN 978-0-19-514850-3, S. 457–468.
- Snyder L, Champness W: Molecular Genetics of Bacteria, 3rd. Auflage, ASM Press, 2007, ISBN 978-1-55581-399-4.
- Sherwood Casjens: Information about bacteriophage P22. In: ASM Division M: Bacteriophage P22. American Society for Microbiology. Archiviert vom Original am 26. Dezember 2010. Abgerufen am 15. April 2012.
- NCBI: Salmonella phage 34 (no rank)
- Robert Villafane, Milka Zayas, Eddie B. Gilcrease, Andrew M. Kropinski, Sherwood R. Casjens: Genomic analysis of bacteriophage ε34 of Salmonella enterica serovar Anatum (15+), in: BMC Microbiol. 8, S. 227, 17. Dezember 2008, doi:10.1186/1471-2180-8-227, PMC 2629481 (freier Volltext), PMID 19091116
- H. W. Ackermann: The lambda - P22 problem. In: Bacteriophage. 5, Nr. 1, 21. Mai 2012, S. e1017084. doi:10.1080/21597081.2015.1017084. PMID 26442187. PMC 4422791 (freier Volltext).
- NCBI: Bacillus virus phi29 (species)
- NCBI: Salmonella virus P22 (species)
- S. Casjens, M. Hayden: Analysis in vivo of the bacteriophage P22 headful nuclease. In: J. Mol. Biol., 189, 5. Februar 1988, S. 467–474. doi:10.1016/0022-2836(88)90618-3, PMID 3280806
- G. Streisinger, R. Edgar, M. Stahl: Chromosome structure in phage T4. I. Circularity of the linkage map. In: Proc. Natl. Acad. Sci., USA 57, Mai 1964, S. 775–779. doi:10.1073/pnas.51.5.775, PMC 300161 (freier Volltext)
- S. Casjens, E. Wyckoff, M. Hayden, L. Sampson, K. Eppler, S. Randall, E. Moreno, P. Serwer: The bacteriophage P22 portal protein is part of the gauge that determines the length and packing density of intravirion DNA. In: J. Mol. Biol. 224, 1992, S. 1055–1074. doi:10.1016/0022-2836(92)90469-Z, PMID 1569567
- M. Susskind, D. and Botstein: Molecular genetics of bacteriophage P22. In: Microbiol. Rev. 42, Juni 1978, S. 385–413. PMC 281435 (freier Volltext), PMID 353481
- H. Strauss, J. King: Steps in the stabilization of newly packaged DNA during phage P22 morphogenesis. In: J. Mol. Biol.. 172, Nr. 4, Februar 1984, S. 523–543. doi:10.1016/S0022-2836(84)80021-2. PMID 6363718.
- Eppler K, Wyckoff E, Goates J, Parr R, Casjens S: Nucleotide sequence of the bacteriophage P22 genes required for DNA packaging. In: Virology. 183, Nr. 2, August 1991, S. 519–538. doi:10.1016/0042-6822(91)90981-G. PMID 1853558.
- Olia AS, Al-Bassam J, Winn-Stapley DA, Joss L, Casjens SR, Cingolani G: Binding-induced stabilization and assembly of the phage P22 tail accessory factor gp4.. In: J Mol Biol. 363, Nr. 2, 20. Oktober 2006, S. 558–576. doi:10.1016/j.jmb.2006.08.014. PMID 16970964.
- B. L. Neal, P. K. Brown, P. R. Reeves: Use of Salmonella Phage P22 for Transduction in Escherichia coli. In: Journal of Bacteriology. 175, Nr. 21, November 1993, S. 7115–7118. doi:10.1128/jb.175.21.7115-7118.1993. PMID 8226656. PMC 206843 (freier Volltext).
Weblinks
- Stanley Maloy: Genetic Background – Phage P22, auf: San Diego State University (SDSU) – via Webarchiv
- Schaefer KL, McClure WR: Antisense RNA control of gene expression in bacteriophage P22. I. Structures of sar RNA and its target, ant mRNA. In: RNA. 3, Nr. 2, Februar 1997, S. 141–156. PMID 9042942. PMC 1369469 (freier Volltext). (Sar-RNA)