Radiosensitizer
Ein Radiosensitizer (der Begriff Strahlungssensibilisator ist in der deutschsprachigen Fachliteratur kaum etabliert) ist ein Pharmakon, das nach seiner Verabreichung selektiv die Empfindlichkeit von bösartigen Tumorzellen gegenüber ionisierender Strahlung erhöht.[1] Radiosensitizer sind eine Untergruppe der Radiomodulatoren. Radioprotektoren dagegen sind Substanzen, die selektiv das normale gesunde Gewebe schützen und so eine höhere Strahlendosis ermöglichen.[2]
Beschreibung
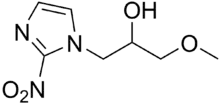
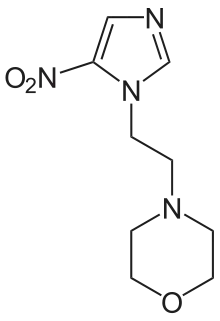
Eines der größten Probleme der konventionellen Strahlentherapie ist die niedrige Strahlungsempfindlichkeit vieler Tumoren im Vergleich zum umgebenden gesunden Gewebe.[3] Die wesentliche Ursache für die niedrige Strahlungsempfindlichkeit ist der Sauerstoffmangel (Hypoxie) in vielen Tumoren, der durch die eher mäßige Ausbildung von neuen Blutgefäßen (Angiogenese) während des Tumorwachstums verursacht wird. Sauerstoff ist ein sehr wirksamer Radiosensitizer. In vitro sind oxygenierte Zellen um den Faktor 2 bis 3 empfindlicher gegen ionisierende Strahlen, als die gleichen Zellen in hypoxischem Milieu.[4][5] Das Verhältnis der Strahlendosis ohne Radiosensitizer zur Strahlendosis mit Radiosensitizer, bei jeweils gleichem In-vitro- oder In-vivo-Effekt wird als Sensitizer Enhancement Ratio (SER) bezeichnet. Das SER ist ein Maß für die Veränderung der Wirkung der Strahlung durch einen Radiosensitizer.[5] Um die Strahlungsempfindlichkeit von Tumoren zu erhöhen, wurden verschiedene Konzepte und eine Reihe von unterschiedlichen Substanzen (Radiosensitizer) entwickelt. Viele Substanzen und Verfahren befinden sich noch in der klinischen Erprobung.
Von den »echten« Radiosensitizern sind „Zytostatika mit synergistischer Wirkung zur Strahlentherapie“, wie beispielsweise Cisplatin, 5-Fluoruracil, Vindesin, Hydroxyharnstoff, Doxorubicin oder Actinomycin D, abzugrenzen.[5]
Therapieansätze und Substanzklassen
Zwischen den bisher in klinischen Studien erhaltenen Ergebnissen und den präklinischen Daten (in vitro und in vivo) besteht eine deutliche Diskrepanz. Folglich gibt es bisher noch keine Empfehlung für einen Radiosensitizer, der in der Fachwelt von einem breiten Konsens getragen wird.[5]
Imitierung des Sauerstoffeffektes

Ein Therapieansatz zur Verbesserung der Radiosensitivierung ist das Imitieren des Sauerstoffeffektes im Tumor. Man versucht den Sauerstoffgehalt in Krebszellen anzuheben, um ihre Empfindlichkeit gegen ionisierende Strahlen zu erhöhen.
Ein Verfahren ist die hyperbare Oxygenierung direkt vor der Bestrahlung.[6][7] Ähnliche Effekte bewirkt Wasserstoffperoxid.[8]
Elektronenaffine Substanzen, wie Misonidazol,[9][10] Nimorazol,[11] Sanazol,[12][13][14][15] Azomycin (2-Nitroimidazol),[16] Metronidazol[17] oder Pimonidazol[18][19] aus der Gruppe der Nitroimidazole, sollen den Sauerstoffeffekt im malignen Gewebe imitieren. In Modellorganismen wurden SER-Werte von 1,3 bis 2,7 gefunden. In Dänemark setzt man Nimorazol gegen Rachen- und Kehlkopfkrebs in der Strahlentherapie ein, da sich das Molekül nach dem Einfang eines langsamen Elektrons als Radikal an durch Strahlung geschädigte DNA bindet und so die DNA-Reparatur in Tumorzellen stört. In Zellen, wo genügend Sauerstoff vorliegt, gibt Nimorazol das eingefangene Elektron wieder an den Sauerstoff ab und wird recycelt. Damit reichert sich das Radikal in sauerstoffarmen Zellen an.[20]
Efaproxiral (RFR13) verändert als Radiosensitizer im Hämoglobin die Aufnahme des Sauerstoffs, der somit schwächer an Hämoglobin bindet und leichter an hypoxisches Gewebe abgegeben wird. Efaproxiral ist ein allosterischer Effektor des Hämoglobins. Die SER-Werte liegen bei 1,8 bis 2,1.[21] Efaproxiral erhöht den zytotoxischen Effekt der Strahlentherapie und der Chemotherapie mit Zytostatika.[1][22][23][24] Im Sommer 2007 wurde die Entwicklung von Efaproxiral, das sich in der klinischen Phase III befand,[25] eingestellt. Bei Brustkrebs-Patientinnen trat – gegenüber Frauen, die nur die Strahlentherapie erhielten – kein signifikanter Überlebensvorteil auf.
DNA-Sensitizer
Ein anderer Weg wird mit DNA-Sensitizern verfolgt. Mit Substanzen wie Bromdesoxyuridin – einem Thymidin-Analogon – wird im Zellkern die Anzahl an DNA-Einzelstrangbrüchen erhöht. Möglicherweise werden auch die intrazellulären Reparaturmechanismen gestört. Ungünstig ist jedoch die Beeinträchtigung gesunder Zellen, mit hoher Proliferationsrate durch Bromdesoxyuridin.[5] Auch Gold-Nanopartikel sind offenbar in der Lage im Zellkern die DNA-Reparaturmechanismen zu hemmen.[26]
Cytarabin, beziehungsweise dessen Stoffwechselprodukt Cytosin-Arabinosid-Triphosphat, wirkt als Radiosensitizer, indem es die Reparaturmechanismen der Krebszellen hemmt. Dies geschieht über die Inhibierung der DNA-Polymerasen.[27][28]
Multifunktionale Radiosensitizer
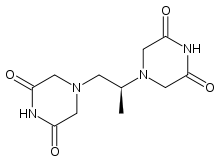
Dexrazoxan (ICRF-187), ein EDTA-Derivat, blockiert in der frühen G2/M-Phase den Zellzyklus. In dieser Phase hat eine Zelle ihre höchste Strahlungsempfindlichkeit.[29] In Modellorganismen konnte zudem eine Normalisierung des tumorösen Blutgefäßsystems festgestellt werden, wodurch die Sauerstoffversorgung des Tumors offensichtlich verbessert wird. Zudem zeigt es eine anti-metastatische Wirkung.[30][5] Es reduziert außerdem signifikant die Kardiotoxizität von Anthracyclinen.[31] Für diese Anwendung ist Dexrazoxan zugelassen.[32] Dexrazoxan konnte in einigen Studien bei bestimmten Tumoren in Kombination mit der Strahlentherapie die Prognose verbessern.[33][34] Dagegen brachte die Gabe von Dexrazoxan bei Zervix-, Bronchial- und Kopf-Hals-Karzinomen keine Vorteile.[5]
Auch N-Methylformamid ist ein multifunktionaler Radiosensitizer.[5][35][36]
Thiolmodulatoren
Thiolmodulatoren sind Verbindungen, die Thiol-Gruppen (-SH) blockieren. Dazu gehören unter anderem N-Ethylmaleinimid, p-Chlormercuribenzoat und Buthioninsulfoximin.[5]
Weitere Substanzklassen
Neben diesen Verbindungen befindet sich eine Vielzahl von anderen Substanzklassen in der (prä)-klinischen Erprobung als Radiosensitizer. Dazu gehören unter anderem Resveratrol,[37] Hydroxychalkone[38] und Motexafin-Gadolinium (Gd-Tex).[39] Motexafin-Gadolinium reichert sich nach systemischer Gabe im Tumor an und katalysiert in der Zelle die Oxidation von reduzierenden Verbindungen wie Ascorbinsäure und Glutathion. Dies löst eine Reaktionskaskade aus, an deren Ende reaktive Sauerstoffspezies generiert werden.[1][40][41]
Medizingeschichtliches
Bereits 1921 machte der deutsche Röntgenologe Hermann Holthusen die Beobachtung, dass die Strahlenempfindlichkeit von Zellen durch Sauerstoff erhöht wird.[5]
Weiterführende Literatur
- L. B. Harrison, M. Chadha, R. J. Hill, K. Hu, D. Shasha: Impact of tumor hypoxia and anemia on radiation therapy outcomes. In: Oncologist. Band 7, Nummer 6, 2002, S. 492–508, ISSN 1083-7159, PMID 12490737, (Review).
- R. Wideröe: Optimization of cancer radiotherapy with selective sensitizers. In: Strahlentherapie und Onkologie. Band 163, Nummer 6, Juni 1987, S. 378–384, ISSN 0179-7158, PMID 3603365.
- S. Dische: Sensitizers in radiotherapy. In: British journal of hospital medicine. Band 27, Nummer 5, Mai 1982, S. 502, 507–502, 510, ISSN 0007-1064, PMID 7093576.
Einzelnachweise
- J. Voges: Strahlentherapie. In: U. Schlegel, M. Weller, M. Westphal (Hrsg.): Neuroonkologie Verlag Thieme, ISBN 3-131-09062-6, S. 437–438 (eingeschränkte Vorschau in der Google-Buchsuche).
- B. Kaser-Hotz: Prinzipien der Strahlentherapie. In: M. Kessler (Hrsg.): Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hunden. Georg Thieme Verlag, 2005, ISBN 3-830-44103-7, S. 160 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. J. Lee, M. Moini, J. Giuliano, W. H. Westra: Hypoxic sensitizer and cytotoxin for head and neck cancer. In: Annals of the Academy of Medicine, Singapore. Band 25, Nummer 3, Mai 1996, S. 397–404, ISSN 0304-4602, PMID 8876907 (Review).
- L. B. Harrison, M. Chadha, R. J. Hill, K. Hu, D. Shasha: Impact of tumor hypoxia and anemia on radiation therapy outcomes. In: The oncologist. Band 7, Nummer 6, 2002, S. 492–508, ISSN 1083-7159, PMID 12490737 (Review).
- W. Rhomberg, J. Dunst: Radiosensitizer. In: H. J. Schmoll, K. Höffken, K. Possinger (Hrsg.): Kompendium Internistische Onkologie Standards in Diagnostik und Therapie. Springer, 2005, ISBN 3-540-20657-4, S. 619 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. Ogawa, S. Ishiuchi, O. Inoue, Y. Yoshii, A. Saito, T. Watanabe, S. Iraha, T. Toita, Y. Kakinohana, T. Ariga, G. Kasuya, S. Murayama: Phase II Trial of Radiotherapy after Hyperbaric Oxygenation with Multiagent Chemotherapy (Procarbazine, Nimustine, and Vincristine) for High-Grade Gliomas: Long-Term Results. In: International Journal of Radiation Oncology – Biology – Physics [elektronische Veröffentlichung vor dem Druck] März 2011, ISSN 1879-355X, doi:10.1016/j.ijrobp.2010.12.070, PMID 21420247.
- J. P. Kapp, A. Routh, D. Cotton: Hyperbaric oxygen as a radiation sensitizer in the treatment of brain tumors. In: Surgical Neurology. Band 17, Nummer 3, März 1982, S. 233–235, ISSN 0090-3019, PMID 7079944.
- Y. Ogawa, K. Kubota, H. Ue, Y. Kataoka, M. Tadokoro, K. Miyatake, K. Tsuzuki, T. Yamanishi, S. Itoh, J. Hitomi, N. Hamada, S. Kariya, M. Fukumoto, A. Nishioka, T. Inomata: Phase I study of a new radiosensitizer containing hydrogen peroxide and sodium hyaluronate for topical tumor injection: a new enzyme-targeting radiosensitization treatment, Kochi Oxydol-Radiation Therapy for Unresectable Carcinomas, Type II (KORTUC II). In: International Journal of Oncology. Band 34, Nummer 3, März 2009, S. 609–618, ISSN 1019-6439, PMID 19212665.
- M. Bamberg, P. Tamulevicius, C. Streffer, E. Scherer: Clinical experiences with the radiosensitizer Misonidazol. In: Strahlentherapie. Band 157, Nummer 8, August 1981, S. 524–536, ISSN 0039-2073, PMID 7268822.
- R. P. Hill: Sensitizers and radiation dose fractionation: results and interpretations. In: International journal of radiation oncology, biology, physics. Band 12, Nummer 7, Juli 1986, S. 1049–1054, ISSN 0360-3016, PMID 2943705, (Review).
- M. Bache, M. Kappler, H. M. Said, A. Staab, D. Vordermark: Detection and specific targeting of hypoxic regions within solid tumors: current preclinical and clinical strategies. In: Current Medicinal Chemistry. Band 15, Nummer 4, 2008, S. 322–338, ISSN 0929-8673, PMID 18288988, (Review).
- W. Dobrowsky, N. G. Huigol, R. S. Jayatilake, N. I. Kizilbash, S. Okkan, T. V. Kagiya, H. Tatsuzaki: AK-2123 (Sanazol) as a radiation sensitizer in the treatment of stage III cancer cervix: initial results of an IAEA multicentre randomized trial. In: Journal of Cancer Research and Therapeutics. Band 1, Nummer 2, 2005 Apr-Jun, S. 75–78, ISSN 1998-4138, PMID 17998631.
- R. Rajagopalan, T. V. Kagiya, C. K. Nair: Radiosensitizer sanazole (AK-2123) enhances gamma-radiation-induced apoptosis in murine fibrosarcoma. In: Journal of radiation research. Band 44, Nummer 4, Dezember 2003, S. 359–365, ISSN 0449-3060, PMID 15031563.
- C. Sugie, Y. Shibamoto, M. Ito, H. Ogino, H. Suzuki, Y. Uto, H. Nagasawa, H. Hori: Reevaluation of the radiosensitizing effects of sanazole and nimorazole in vitro and in vivo. In: Journal of radiation research. Band 46, Nummer 4, Dezember 2005, S. 453–459, ISSN 0449-3060, PMID 16394636.
- W. Dobrowsky, N. G. Huigol, R. S. Jayatilake, N. I. Kizilbash, S. Okkan, V. T. Kagiya, H. Tatsuzaki: AK-2123 (Sanazol) as a radiation sensitizer in the treatment of stage III cervical cancer: results of an IAEA multicentre randomised trial. In: Radiotherapy and Oncology. Band 82, Nummer 1, Januar 2007, S. 24–29, ISSN 0167-8140. doi:10.1016/j.radonc.2006.11.007, PMID 17161478.
- M. E. Watts, M. F. Dennis, I. J. Roberts: Radiosensitization by misonidazole, pimonidazole and azomycin and intracellular uptake in human tumour cell lines. In: International journal of radiation biology. Band 57, Nummer 2, Februar 1990, S. 361–372, ISSN 0955-3002, PMID 1968500.
- D. Nori, J. M. Cain, B. S. Hilaris, W. B. Jones, J. L. Lewis: Metronidazole as a radiosensitizer and high-dose radiation in advanced vulvovaginal malignancies, a pilot study. In: Gynecologic Oncology. Band 16, Nummer 1, August 1983, S. 117–128, ISSN 0090-8258, PMID 6884824.
- D. J. Chaplin, M. R. Horsman: Tumor blood flow changes induced by chemical modifiers of radiation response. In: International journal of radiation oncology, biology, physics. Band 22, Nummer 3, 1992, S. 459–462, ISSN 0360-3016, PMID 1735678.
- D. J. Chaplin: The effect of therapy on tumour vascular function. In: International journal of radiation biology. Band 60, Nummer 1–2, 1991, S. 311–325, ISSN 0955-3002, PMID 1677988, (Review).
- Rebecca Meißner, Jaroslav Kočišek, Eugen Illenberger, Stephan Denifl: Low-energy electrons transform the nimorazole molecule into a radiosensitiser. Nature Communications 10, 2388 (2019) doi:10.1038/s41467-019-10340-8
- B. A. Teicher, J. S. Wong, H. Takeuchi, L. M. Gravelin, G. Ara, D. Buxton: Allosteric effectors of hemoglobin as modulators of chemotherapy and radiation therapy in vitro and in vivo. In: Cancer Chemotherapy and Pharmacology. Band 42, Nummer 1, 1998, S. 24–30, ISSN 0344-5704, PMID 9619754.
- E. T. Donnelly, Y. Liu, S. Rockwell: Efaproxiral (RSR13) plus oxygen breathing increases the therapeutic ratio of carboplatin in EMT6 mouse mammary tumors. In: Experimental biology and medicine (Maywood, N.J.). Band 231, Nummer 3, März 2006, S. 317–321, ISSN 1535-3702, PMID 16514179.
- R. H. Engel, V. G. Kaklamani: Role of efaproxiral in metastatic brain tumors. In: Expert Review of Anticancer Therapy. Band 6, Nummer 4, April 2006, S. 477–485, ISSN 1744-8328. doi:10.1586/14737140.6.4.477, PMID 16613536, (Review).
- C. Scott, J. Suh, B. Stea, A. Nabid, J. Hackman: Improved survival, quality of life, and quality-adjusted survival in breast cancer patients treated with efaproxiral (Efaproxyn) plus whole-brain radiation therapy for brain metastases. In: American Journal of Clinical Oncology. Band 30, Nummer 6, Dezember 2007, S. 580–587, ISSN 1537-453X. doi:10.1097/COC.0b013e3180653c0d, PMID 18091051.
- J. H. Suh, B. Stea, A. Nabid, J. J. Kresl, A. Fortin, J. P. Mercier, N. Senzer, E. L. Chang, A. P. Boyd, P. J. Cagnoni, E. Shaw: Phase III study of efaproxiral as an adjunct to whole-brain radiation therapy for brain metastases. In: Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Band 24, Nummer 1, Januar 2006, S. 106–114, ISSN 1527-7755. doi:10.1200/JCO.2004.00.1768, PMID 16314619.
- D. B. Chithrani, S. Jelveh, F. Jalali, M. van Prooijen, C. Allen, R. G. Bristow, R. P. Hill, D. A. Jaffray: Gold nanoparticles as radiation sensitizers in cancer therapy. In: Radiation research. Band 173, Nummer 6, Juni 2010, S. 719–728, ISSN 1938-5404. doi:10.1667/RR1984.1, PMID 20518651.
- E. Richter, T. Feyerabend: Grundlagen der Strahlentherapie. Verlag Springer, 2002, ISBN 3-540-41265-4, S. 80 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. J. D'Angio: Regarding the alleged radiosensitization of intrathecal cytarabine. In: Journal of pediatric hematology/oncology. Band 27, Nummer 7, Juli 2005, S. 349–350, ISSN 1077-4114, PMID 16012322.
- K. Hellmann, W. Rhomberg: Radiotherapeutic enhancement by razoxane. In: Cancer Treatment Reviews. Band 18, Nummer 4, Dezember 1991, S. 225–240, ISSN 0305-7372, PMID 1842574, (Review).
- K. Hellmann, M. Goold, N. Higgins, R. H. Phillips: Responses of liver metastases to radiotherapy and razoxane. In: Journal of the Royal Society of Medicine. Band 85, Nummer 3, März 1992, S. 136–138, ISSN 0141-0768, PMID 1556714. PMC 1294812 (freier Volltext).
- Dexrazoxan beugt der Kardiotoxizität von Anthrazyklinen vor. In: Ärzte Zeitung vom 20. Juli 2007
- R. C. Kane, W. D. McGuinn, R. Dagher, R. Justice, R. Pazdur: Dexrazoxane (Totect): FDA review and approval for the treatment of accidental extravasation following intravenous anthracycline chemotherapy. In: The oncologist. Band 13, Nummer 4, April 2008, S. 445–450, ISSN 1083-7159. doi:10.1634/theoncologist.2007-0247, PMID 18448560.
- W. Rhomberg, H. Stephan, F. Böhler, K. Erhart, H. Eiter: Radiotherapy and razoxane in advanced bile duct carcinomas. In: Anticancer Research. Band 25, Nummer 5, 2005 Sep-Oct, S. 3613–3618, ISSN 0250-7005, PMID 16101189.
- W. Rhomberg, H. Eiter, F. Böhler, S. Dertinger: Combined radiotherapy and razoxane in the treatment of chondrosarcomas and chordomas. In: Anticancer Research. Band 26, Nummer 3B, 2006 May-Jun, S. 2407–2411, ISSN 0250-7005, PMID 16821624.
- K. Clagett-Carr, G. Sarosy, J. Plowman, D. F. Hoth, B. Leyland-Jones: N-methylformamide: cytotoxic, radiosensitizer, or chemosensitizer. In: Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Band 6, Nummer 5, Mai 1988, S. 906–918, ISSN 0732-183X, PMID 3284976, (Review).
- C. M. Arundel, C. M. Vines, P. J. Tofilon: Chromatin modifications associated with N-methylformamide-induced radiosensitization of clone A cells. In: Cancer Research. Band 48, Nummer 20, Oktober 1988, S. 5669–5673, ISSN 0008-5472, PMID 3167825.
- H. F. Liao, C. D. Kuo, Y. C. Yang, C. P. Lin, H. C. Tai, Y. Y. Chen, Y. J. Chen: Resveratrol enhances radiosensitivity of human non-small cell lung cancer NCI-H838 cells accompanied by inhibition of nuclear factor-kappa B activation. In: Journal of radiation research. Band 46, Nummer 4, Dezember 2005, S. 387–393, ISSN 0449-3060, PMID 16394628.
- R. Pruitt, N. Sasi, M. L. Freeman, K. R. Sekhar: Radiosensitization of cancer cells by hydroxychalcones. In: Bioorganic & medicinal chemistry letters. Band 20, Nummer 20, Oktober 2010, S. 5997–6000, ISSN 1464-3405. doi:10.1016/j.bmcl.2010.08.081, PMID 20826087. PMC 2946792 (freier Volltext).
- D. Francis, G. M. Richards, A. Forouzannia, M. P. Mehta, D. Khuntia: Motexafin gadolinium: a novel radiosensitizer for brain tumors. In: Expert Opinion on Pharmacotherapy. Band 10, Nummer 13, September 2009, S. 2171–2180, ISSN 1744-7666. doi:10.1517/14656560903179325, PMID 19640206.
- D. Magda, C. Lepp, N. Gerasimchuk, I. Lee, J. L. Sessler, A. Lin, J. E. Biaglow, R. A. Miller: Redox cycling by motexafin gadolinium enhances cellular response to ionizing radiation by forming reactive oxygen species. In: International journal of radiation oncology, biology, physics. Band 51, Nummer 4, November 2001, S. 1025–1036, ISSN 0360-3016, PMID 11704327.
- S. Xu, K. Zakian, H. Thaler, C. Matei, A. Alfieri, Y. Chen, J. A. Koutcher: Effects of Motexafin gadolinium on tumor metabolism and radiation sensitivity. In: International journal of radiation oncology, biology, physics. Band 49, Nummer 5, April 2001, S. 1381–1390, ISSN 0360-3016, PMID 11286846.