Osedax
Osedax ist eine Gattung der Bartwürmer (Siboglinidae), die sich auf die Besiedlung von Skeletten auf dem Meeresgrund spezialisiert hat. Die weiblichen Würmer leben sessil auf den Knochen abgesunkener toter Tiere und ernähren sich über eine Art Wurzelsystem von Nährstoffen im Knochen. Sie lösen den Knochen dabei durch Säureabsonderung auf und setzen so die Nährstoffe aus dem Mineraliengerüst frei. Bei der Verdauung der Fette und Proteine aus dem Knochen spielen endosymbiontische Bakterien eine Rolle, die in einem spezialisierten Gewebe des Wurzelsystems leben. Die mikroskopisch kleinen Männchen (Zwergmännchen) gleichen bis auf ihre Geschlechtsorgane völlig dem Larvenstadium und leben in großer Zahl in den Wohnröhren der Weibchen.
| Osedax | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Osedax frankpressi auf einem Walknochen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Osedax | ||||||||||||
| Rouse et al., 2004 |
Entdeckt wurde Osedax im Jahr 2002. Ein Wissenschaftler des Monterey Bay Aquarium Research Institute suchte mit einem Tauchroboter (ROV) nach Tiefseemuscheln im Monterey Canyon, fand jedoch durch Zufall in drei Kilometern Tiefe das Skelett eines Grauwals (Eschrichtius robustus). Dessen Knochen waren dicht besiedelt von Osedax.[1] 2004 erfolgte dann in Science die Erstbeschreibung der Gattung durch Greg W. Rouse, Shana K. Goffredi und den Entdecker Robert C. Vrijenhoek. Der Name ist dem Lateinischen entlehnt und bedeutet „knochenfressend“.[2]
Morphologie
Morphologie des Weibchens

Für die Gattung typisch sind die einige Zentimeter langen adulten Weibchen. Ihr zylindrischer Rumpf ragt aus dem besiedelten Walknochen heraus und liegt in einer durchsichtigen und gelatinösen Röhre, die von Drüsenzellen der Rumpfepidermis abgesondert wird. Die Rumpfwand beinhaltet neben dem Drüsengewebe auch Längsmuskulatur, mit der sich der Wurm bei Gefahr in seine Röhre zurückziehen kann. Im unteren Teil des Rumpfs liegt das Herz, von dem gut ausgeprägte Blutgefäße ausgehen. Wie für Bartwürmer typisch, besitzen adulte Osedax keinen Mund, Darmtrakt und Anus. Ins offene Wasser ragen von der Rumpfspitze vier Ärmchen, die fein gefiedert oder glatt (O. nude palp) sein können; die glatten Ärmchen der sogenannten „O. nude palp“ sind allerdings nur makroskopisch glatt, und zeigen unter dem Mikroskop eine gelappte Oberfläche.[3] Die Ärmchen dienen als kiemenartige Atmungsorgane und sind meistens rötlich gefärbt, können aber auch grünlich oder fast weiß sein. Zwischen diesen Ärmchen befinden sich die Enden der länglichen Eileiter. Sie entspringen an der Basis des Rumpfs und verlaufen längs des Rumpfs in der Röhre, bis sie zwischen den Kiemen ins Seewasser hinausragen. An seiner Basis geht der Rumpf in eine rundliche Verdickung über, den sogenannten ovisac. Ab diesem Teil ist der Wurm in seinem Substratknochen eingebettet. Vom ovisac gehen wurzelartige, grünliche Verzweigungen aus, die den Knochen aushöhlen.[2][4] Eine markante Ausnahme von diesem Körperbau stellt die noch unbeschriebene Art Osedax spiral dar: Ihr dem Wasser zugewandtes Rumpfende hat keine Ärmchen, sondern endet spiralig gedreht. Ihre Eileiter ragen nicht aus dem Rumpf heraus.[4]
Der ovisac und die Wurzeln sind nach außen hin von einem einschichtigen Epithel umgeben, an das sich nach innen eine dünne und unauffällige Schicht von Muskulaturzellen anschließt. Zwischen diesen Schichten und einem einschichtigen, das Coelom umschließenden Peritoneum liegt eine dicke, grüne Gewebeschicht. Sie enthält die Bacteriocyten, welche die endosymbiontischen Bakterien von Osedax beherbergen. Die Bakterien liegen teils frei im Zellplasma, teils sind sie in Vakuolen eingeschlossen. Als weitere Organellen dieser Zellen gibt es nur einen Zellkern und sternförmige Strukturen unbekannter Funktion. Daneben existieren in diesem Gewebe auch bakterienfreie Zellen mit einem stark ausgeprägten endoplasmatischen Retikulum. Vergleichbare Gewebe zur Behausung von endosymbiontischen Bakterien sind von allen Bartwürmern bekannt und werden Trophosom genannt. Es ist jedoch unklar, ob die verschiedenen Ausprägungen von Bakterien beherbergendem Gewebe bei den Bartwürmern homologe Strukturen sind. Bei Osedax entsteht das Trophosom aus dem somatischen Teil des lateralen Mesoderms,[5] bei anderen Bartwürmern meist aus einer anderen Region des Mesoderms und teilweise auch aus dem Entoderm.[6]
Morphologie des Männchens
Die Männchen der meisten Osedax-Arten sind mit 0,2 bis 1,1 Millimetern extrem klein. Ihre Körperorganisation entspricht der einer kürzlich angesiedelten Trochophora-Larve, mit einem Prostomium, einem nach hinten unklar abgegrenzten Peristomium und anschließend einem längeren und einem kürzeren Körpersegment, ohne erkennbares Pygidium. Zahlreiche larvale Merkmale sind noch vorhanden, wie der Prototroch genannte Zilienring an der Grenze von Prostomium und Peristomium. Mundöffnung und Verdauungstrakt sind nicht vorhanden, sie ernähren sich für ihre Lebenszeit von Dotter. Ventral am Vorderende der als Segment 1 zusammengefassten Einheit von Peristomium und dem langen Segment liegen Spermatogonien. Die von ihnen erzeugten Spermatiden reifen zu Spermien, die von ventral gelegenen, paarigen Zilienbändern an der inneren Körperwand der Männchen in den hinter dem Prostomium gelegenen Samenleiter befördert werden. Der Samenleiter mündet in das sackartige Seminalvesikel, in dem die Spermien angesammelt werden. Aus dem Seminalvesikel mündet die Geschlechtsöffnung der Männchen. Die Männchen behausen keine endosymbiontischen Bakterien.[7]
Eine Ausnahme stellen die Männchen von O. priapus dar – sie erreichen ein Drittel der Körpergröße von Weibchen ihrer Art und sind gleichartig in einen aus dem Knochen ragenden Rumpf und ein in den Knochen eingebettetes Wurzelsystem organisiert. Sie können ihren im Ruhezustand kontrahierten Rumpf auf ein Vielfaches seiner Ruhelänge ausstrecken, um über eine Geschlechtspore an der Spitze ihres Rumpfes in Nachbarschaft siedelnde Weibchen zu besamen. Außerdem besitzen sie wie die Weibchen ein Trophosom mit endosymbiontischen Bakterien. Die Vorfahren dieser Art hatten vermutlich bereits die sonst für die Gattung typischen Zwergmännchen; deren fortgesetzte Entwicklung bei O. priapus stellte damit einen evolutionary reversal dar, wie er nur selten vorkommt (siehe Dollosches Gesetz).[8][9]
Ökologie
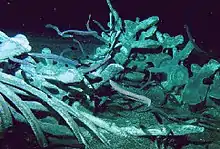
Osedax sind Meeresbewohner und besiedeln Knochen von Wirbeltieren, die nach ihrem Tod auf den Meeresboden abgesunken sind. Nahrungsquelle für Osedax sind die in der mineralischen Matrix (Gerüst) des Knochens eingebetteten Strukturproteine (z. B. Kollagen) und Fette. Die Tiere sind weltweit in Meerestiefen von 20 Metern bis über 4 Kilometern[10] gefunden worden. Das charakteristische Substrat für weibliche Osedax-Würmer sind die Knochen von Walen.[11][12]
Wenn ein Walkadaver auf den Meeresgrund absinkt, stellt er einen enormen Nährstoffimpuls für die ansonsten nährstoffarmen Bodenregionen der Tiefsee dar. Die Substanz eines Wals bildet Grundlage für ein ganzes Ökosystem, welches eine charakteristische Sukzession aufweist. Anfänglich fressen mobile Aasfresser wie Schleimaale, Schlafhaie, Grenadierfische und diverse Wirbellose über Monate bis teils auch Jahre hinweg das Weichgewebe des Wals. Ist das Skelett freigelegt, beuten opportunistische Krebstiere und Vielborster noch die Reste an den Knochen sowie das organisch angereicherte Sediment um den Wal herum aus. Die Knochen selbst enthalten bei Walen viel chemisch gebundene Energie, da sie für verbesserte hydrostatische Eigenschaften zu stark fetthaltigen Spongiosaknochen umgebildet sind. Die Fette und Kollagene im Walknochen werden unter anderem von spezialisierten, sulfatatmenden Bakterien ausgebeutet.[13] In dieser von freigelegten Walknochen charakterisierten Phase besiedeln dann auch Osedax-Würmer das Skelett des Wals, teilweise auch mehrere Arten von Osedax gleichzeitig. Von einer bestimmten Osedax-Art besiedelte Walgerippe können nach nur wenigen Monaten vollständig von einer anderen Osedax-Art besiedelt sein.[14] Im Monterey Canyon etwa befindet sich auf kürzlich freigelegten Walgerippen am häufigsten die Art O. rubiplumus, die ein flaches und fadenartiges Wurzelsystem ausbildet und damit insbesondere die kollagenreichen äußeren Schichten des Knochens ausbeutet. Auf älteren Gerippen wird diese Art dann von O. frankpressi abgelöst, deren lappenförmige und robuste Wurzeln tiefer in den Knochen eindringen und damit insbesondere die schwammartig gebauten inneren, fettreichen Knochenareale ausbeutet.[15] In den späten Stadien dieser Sukzession ist die noch unbeschriebene taxonomische Einheit „O. spiral“ darauf spezialisiert, mit ihren Wurzeln bereits von Sediment bedeckte Knochenstücke auszubeuten.[16] Die verschiedenen Ausprägungen des Wurzelsystems koexistierender Osedax-Arten deuten auf eine Nischenteilung hin, die ein wichtiger Faktor für die Artbildung bei Osedax sein könnte. Oft sind jedoch auch Arten mit nahezu gleicher Wurzelmorphologie auf einem Gerippe präsent, was eher für eine neutrale Theorie spricht.[15][17]
Osedax ist nicht ausschließlich auf Walknochen spezialisiert, sondern besiedelt auch die Knochen von Fischen, anderen Säugetieren, Vögeln und in seltenen Fällen Weichgewebe von Walen wie etwa das Spermaceti von Pottwalen.[18][19][20][17]
Fortpflanzung und Entwicklung
Weibchen von Osedax werden von den Männchen befruchtet, die sich in ihrer gelatinösen Wohnröhre angesiedelt haben. In den Wohnröhren älterer Weibchen leben einige wenige[21] bis über 100 der mikroskopisch kleinen Männchen.[2] Die Spermien der Männchen werden einzeln frei schwimmend und nicht als Spermatophore freigesetzt, es erfolgt eine noch nicht näher charakterisierte innere Befruchtung.[22] Geschlechtsreife, mit Männchen besiedelte Weibchen setzen im Labor durchschnittlich 335 befruchtete Eier pro Tag frei. Anscheinend werden die Eier von Art zu Art unterschiedlich direkt ins freie Wasser gegeben, oder durchlaufen ihre frühe Entwicklung im Wohnröhrenschleim des Weibchens. Die Eizelle durchläuft eine ungleiche Spiralfurchung, und nach ein bis drei Tagen hat sich eine freischwimmende Trochophora gebildet. Diese kann aktiv schwimmen und etwa zwei Wochen von ihren Dottervorräten leben. Die Larven können sich dann auf Knochen ansiedeln, wobei die erste Verankerung vermutlich über zwei hakenförmige Chaetae (Borsten) erfolgt. Sie beginnen dann mit der Absonderung der gelatinösen Wohnröhre und der Ausbildung von Adultmerkmalen des Weibchens, wie etwa den Kiemenärmchen und dem Wurzelsystem. Größere Weibchen werden nach und nach von kleinen Männchen besiedelt, bis in der Population eine große Überzahl an Männchen lebt. Als mögliche Grundlage dieser Populationsdynamik wird eine umweltabhängige Geschlechtsdetermination bei Osedax diskutiert: Siedelt sich eine Larve auf einem Knochen an, entwickelt sie sich zum Weibchen – hingegen wird sie zu einem Männchen, wenn ihre Ansiedlung auf einem adulten Weibchen erfolgt.[23][24] Eindeutige Belege für diese Hypothese gibt es noch nicht.[8]
Physiologie
Nahrungsaufnahme
Die Nährstoffaufnahme des Weibchens aus den Knochen erfolgt über das Wurzelsystem, welches bis in die Spitzen mit Blutgefäßen versorgt ist. Die in Kontakt mit der Umgebung stehenden Epithelzellen der Wurzeln zeigen viele oberflächenvergrößernde Mikrovilli, wie sie für stoffaustauschende Epithelien typisch sind, sowie eine auffallend hohe Dichte von Mitochondrien. Dem Aufschluss von Proteinen und Lipiden aus der anorganischen Knochenmatrix dienen in der Epithelmembran eingebettete H+-ATPasen, die unter ATP-Verbrauch Protonen (H+) aus den Epithelzellen pumpen. Die aus den Epithelzellen gepumpten H+ säuern das Knochenmilieu an und lösen in der Folge das mineralische Knochengerüst aus Calciumphosphaten wie Hydroxylapatit auf. Die nun freigelegten Proteine und Fette werden dann über die Membran des Wurzelepithels aufgenommen. Beständigen Nachschub an Protonen für dieses Verfahren liefert Kohlensäure (H2CO3, dissoziiert zu H+ + HCO3−), das aus einer Reaktion von Wasser mit Kohlenstoffdioxid entsteht. Die Bildung von Kohlensäure aus Wasser und Kohlenstoffdioxid wird gefördert von einer Carboanhydrase, die das Wurzelgewebe der Würmer in großen Mengen herstellt.[25]
Dieses Verfahren zur Knochenauflösung erfordert eine ständige Neubildung von Kohlensäure. Das hierzu benötigte Kohlenstoffdioxid stammt aus der sauerstoffzehrenden Zellatmung – die unmittelbare Umgebung der Knochen und damit auch der Wurzeln ist jedoch aufgrund bakterieller Aktivitäten extrem sauerstoffarm (anoxisch). Um den eigenen Stoffwechsel und den der endosymbiontischen Bakterien mit genügend Sauerstoff zu versorgen, verfügen die Weibchen von Osedax mit ihren weit über die Substratknochen herausragenden Kiemenarmen über sehr effiziente Atmungsorgane.[26] Über diese Kiemen wird wahrscheinlich auch überschüssiges HCO3− entsorgt, um es dem Reaktionsgleichgewicht der Kohlensäurebildung zu entziehen und die Bildung von neuem H2CO3 zu fördern.[25] Sulfatatmende Bakterien erzeugen außerdem hohe Konzentrationen von hochgiftigem Schwefelwasserstoff im Knochenmilieu; noch ist unbekannt, welcher physiologische Mechanismus es Osedax erlaubt, diese hohen Konzentrationen zu tolerieren.[26]
Endosymbiose
Die durch die Wurzeln aufgenommenen Proteine und Fette aus den besiedelten Knochen dienen Osedax als Quelle von Energie und organischen Verbindungen. Eine wichtige Rolle im Stoffwechsel und der Ernährung der Würmer spielen γ-Proteobakterien aus der Ordnung der Oceanospirillales. Stämme dieser Bakteriengruppe werden in adulten Weibchen von Osedax stets angetroffen und stehen mit den Würmern in einer symbiontischen Beziehung, die den Wurm in seinem Stoffwechsel und seiner Ernährung unterstützt.[2] Bei einzelnen Arten von Osedax wurden auch Vertreter der ε-Proteobakterien als Endosymbionten gefunden.[27] Die Bakterien werden nicht von den Elterntieren an die Jungtiere weitergegeben, sondern von jedem Individuum aus der Umwelt erneut aufgenommen.[28] Ein Individuum kann sich dabei aus mehreren, sich opportunistisch ereignenden Infektionen verschiedene Bakterienstämme als Endosymbionten aneignen. Einzelne Bakterienstämme scheinen nicht spezifisch an bestimmte Osedax-Arten gebunden zu sein.[15] Für ein vermutetes freilebendes Stadium der symbiontischen Bakterien sprechen genetische Befunde an zwei Stämmen von bei Osedax endosymbiontischen Oceanospirillales: Sie besitzen Gene zur Bildung von Geißeln sowie für Rezeptoren zur Erkennung von extrazellulären Molekülen, die in einem freien Lebensstadium der Fortbewegung und dem Auffinden von Osedax-Wirten dienen könnten.[29] Die Symbiose ist noch nicht völlig verstanden; Bartwürmer gehen häufig Symbiosen mit Bakterien ein, dies sind dann jedoch meistens chemoautotrophe Bakterien, die zur Fixierung von freiem Kohlenstoff in der Lage sind. Die Symbionten von Osedax sind heterotroph, was für Bartwürmer einzigartig ist. Dies heißt, dass zunächst der Wurm seine Symbionten mit Energie und Vorläufermolekülen versorgen muss, bevor er Nutzen aus dem Stoffwechsel der Bakterien ziehen kann.[29]
Eine Rolle der Bakterien im Fettsäurestoffwechsel des Wurms ist ersichtlich in der Abundanz von cis-Vaccensäure und Eicosapentaensäure in deren Gewebe. Erstere ist ein typisches Endprodukt von mikrobiellem Fettsäurestoffwechsel, letztere ist bekannt als Membranbestandteil einiger Oceanospirillales-Tiefseemikroben, da sie unter hohem Druck und bei niedrigen Temperaturen zur Erhaltung der Biomembranfluidität beiträgt. Zumindest einen Teil seiner Fettsäuren bezieht der Wurm also aus dem Stoffwechsel der γ-Proteobakterien. Wachsester, deren gebundene Fettsäuren mit hoher Wahrscheinlichkeit cis-Vaccensäuren sind, dienen Osedax als Speicherstoffe.[30] Entgegen früheren Annahmen[27] kommt den Symbionten keine kollagenlösende (kollagenolytische) Funktion zu, da sich in deren Genomen keine Gene für Kollagenasen finden. Dieses Strukturprotein der Knochen wird vermutlich zunächst vom Wurm in Oligopeptide und Aminosäuren gespalten, bevor es den Bakterien zukommt. Genomanalysen von Symbiontenstämmen zeigten die Fähigkeit dieser Bakterien zur Neusynthese aller B-Vitamine, inklusive des für alle Tiere essentiellen Vitamin B12, sowie zur Neusynthese von 18 der 20 natürlichen Aminosäuren. Sie besitzen außerdem Gene, die Exportproteine für verschiedene essentielle Aminosäuren codieren. Im Rahmen der Symbiose erhalten die Bakterien also vom Wurm aus dem Knochen freigesetzte Fette, Proteine und andere Moleküle. Im Gegenzug erhält der Wurm Fettsäuren sowie essentielle Aminosäuren und Vitamine aus dem Stoffwechsel der Bakterien.[29]
Teilungsaktive Bakteriocyten mit intakten Symbionten sind insbesondere im Wurzelgewebe vorhanden, während in Bakteriocyten in Richtung des ovisac zunehmend eine Verdauung von Symbionten innerhalb von Vakuolen stattfindet. Außerdem steigt im Bereich des ovisac die Häufigkeit von in der Apoptose befindlichen Bakteriocyten. Vermutet wird daher ein bestimmter Lebenszyklus von Bakteriocyten und Endosymbionten, der im teilungsaktiven Gewebe der Wurzeln beginnt und nach Wanderung in Richtung des ovisac mit Verdauung der Bakterien und Apoptose der Bakteriocyte endet.[5]
Systematik
Verwandtschaftsverhältnisse der Siboglinidae[2]
|
Morphologische Merkmale und DNA-Analysen weisen Osedax als der Familie der Bartwürmer (Siboglinidae) zugehörig aus. Schwestergruppe von Osedax ist eine Klade aus Vestimentifera (eine Großgruppe der Bartwürmer) und deren Schwestergruppe, die bisher kaum erforschte Gattung Sclerolinum. Osedax und die Klade aus Vestimentifera und Sclerolinum bilden die Schwestergruppe zur anderen Großgruppe der Bartwürmer, den Frenulata. Die Typusart von Osedax ist O. rubiplumus.[2] Mittlerweile sind weltweit 25 Arten von Osedax mit einem wissenschaftlichen Namen beschrieben worden:
- O. antarcticus Glover et al. 2013, Südpolarmeer (Bransfield-Straße)[11]
- O. bryani Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. crouchi Amon et al. 2014, Südpolarmeer (Bransfield-Straße)[3]
- O. deceptionensis Glover et al. 2013, Südpolarmeer (Bransfield-Straße)[11]
- O. docricketts Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. fenrisi Eilertsen, Dahlgren & Rapp 2020, Arktischer Ozean[32]
- O. frankpressi Rouse et al. 2004, Nordostpazifik (Monterey Bay Canyon vor Kalifornien)[2]
- O. japonicus Fujikura et al. 2006, Westpazifik vor Südwest-Kyushu (Japan)[20]
- O. jabba Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. knutei Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. lehmani Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. lonnyi Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. mucofloris Glover et al. 2005, Nordatlantik vor Schweden und Norwegen[33][34]
- O. nordenskjoeldi Amon et al. 2014, Südpolarmeer (Bransfield-Straße)[3]
- O. packardorum Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. priapus Rouse et al. 2015, Nordostpazifik (Monterey Bay Canyon vor Kalifornien)[8]
- O. randyi Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. rogersi Amon et al. 2014, Südpolarmeer (östliche Scotiasee)[3]
- O. roseus Rouse et al. 2008, Nordostpazifik (Monterey Bay Canyon vor Kalifornien)[21]
- O. rubiplumus Rouse et al. 2004, Nordostpazifik (Monterey Bay Canyon vor Kalifornien)[2], 2019 auch im Indischen Ozean nachgewiesen, auch im Südwest-Atlantik nachgewiesen.[35]
- O. ryderi Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. sigridae Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. talkovici Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. tiburon Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. ventana Rouse et al. 2018, Monterey Bay, Kalifornien[31]
- O. westernflyer Rouse et al. 2018, Monterey Bay, Kalifornien[31]
Daneben sind jedoch zahlreiche weitere Arten bekannt, deren wissenschaftliche Beschreibung und Benennung noch aussteht.[15][12] Im wissenschaftlichen Diskurs werden sie als operational taxonomic units (OTUs) bezeichnet und erhalten auf ihr Erscheinungsbild bezogene Arbeitsnamen.
Evolution
Stammesgeschichte
Osedax ist eine stammesgeschichtlich sehr alte Gattung. 2015 fand man in einem 100 Millionen Jahre alten Knochen eines Plesiosauriers Aushöhlungen, deren Form den von heutigen Osedax geschaffenen Knochenaushöhlungen entspricht: Einer kurzen zylindrischen Öffnung schließt sich eine durch das Wurzelsystem erzeugte, unregelmäßig geformte Aushöhlung an. Dieser bisher älteste Fund von Osedax-Spuren deutet darauf hin, dass die Evolution von Osedax zeitlich an das Aufkommen großer mesozoischer Meeresreptilien angeschlossen war. Deren Gerippe dienten den frühen Osedax-Würmern als Nahrung. Ebenfalls kreidezeitliche Spuren von Osedax wurden auf fossilen Knochen von Meeresschildkröten gefunden. Diese Funde verschieben das bisher angenommene, junge evolutionäre Alter der Bartwürmer um viele Millionen Jahre zurück bis ins Mesozoikum.[36] Nach dem Aussterben der großen Meeresreptilien an der KT-Grenze überlebte Osedax durch die hoch spezialisierte Ernährungsweise, die sie auch die Knochen kleinerer Meerestiere besiedeln lässt. Dazu gehörten einerseits Meeresschildkröten,[36] andererseits sind auch oligozäne Osedax-Bohrungen in Fossilien früher Seevögel der Familie Plotopteridae[37] und in versteinerten Fischknochen bekannt.[38] Mit dem Auftreten der Wale erschloss sich Osedax mit deren Gerippen eine neue und die heute wohl wichtigste Nahrungsquelle, wie Bohrungen in oligozänen und pliozänen Walfossilien belegen.[39][40] Einige Paläontologen vermuten, dass Osedax durch den Konsum von Knochen die fossile Erhaltung von Meereswirbeltieren maßgeblich beeinträchtigt hat. Der sogenannte „Osedax-Effekt“ müsse bei der Auswertung des Fossilbelegs vieler Wirbeltiergruppen berücksichtigt werden.[39][36]
Männchenverzwergung
Die Evolution von Zwergmännchen wird oft gefördert von Ressourcenknappheit, schwieriger Partnersuche, einer sessilen Lebensweise und geringer Konkurrenz zwischen Männchen um Weibchen. Bei einer Lebensweise in der Tiefsee auf nur sporadisch vorhandenen Gerippen trafen diese Faktoren für Osedax zu und förderten die Evolution eines markanten Geschlechtsdimorphismus. Hierbei haben diejenigen Weibchen eine höhere evolutionäre Fitness, die auf den knapp vorhandenen Ressourcen (Knochen) schnell wachsen und diese effizient ausbeuten können, und so eine höhere Fruchtbarkeit erzielen. Bei Männchen hingegen ist eine frühe Geschlechtsreife und hohe Mobilität vorteilhaft – dies erhöht die Wahrscheinlichkeit, eine der weitläufig verstreuten Habitatinseln zu erreichen und ein Weibchen zu befruchten. Dieser Selektionsdruck führte bei den Männchen zu einer Geschlechtsreife im Larvenstadium. So wurde auch die Konkurrenz um die begrenzten Ressourcen zwischen Weibchen und Männchen eliminiert.[41] Der Rückfall bei O. priapus zu größeren Männchen ist noch ungeklärt, allerdings erreichen auch bei dieser Art die Männchen nur ein Drittel der Körpergröße von Weibchen. Sexuelle Selektion könnte die Entstehung größerer Männchen gefördert haben, da ein solches Männchen mit ausstreckbarem Rumpf Zugang zu mehreren Weibchen hat, und so mehr Nachkommenschaft zeugen kann als ein Zwergmännchen, welches auf die Wohnröhre eines einzelnen Weibchens beschränkt ist. Noch ist zu wenig über die Biologie dieser Art bekannt, um fundierte Aussagen zu machen.[8]
Belege
- Osedax, the bone-eating worms (Memento vom 1. Oktober 2015 im Internet Archive), aufgerufen am 6. September 2015
- Rouse, Greg W.; Shana K. Goffredi, Robert C. Vrijenhoek (2004): Osedax: Bone-Eating Marine Worms with Dwarf Males. Science 305(5684), S. 668–671. doi:10.1126/science.1098650
- Amon, Diva J.; Helena Wiklund, Thomas G. Dahlgren, Jonathan T. Copley, Craig R. Smith, Alan J. Jamieson, Adrian G. Glover (2014): Molecular taxonomy of Osedax (Annelida: Siboglinidae) in the Southern Ocean. Zoologie Script 43(4), S. 405–417.
- Vrijenhoek, Robert C.; Shannon B. Johnson, Greg W. Rouse (2009): A remarkable diversity of bone-eating worms (Osedax; Siboglinidae; Annelida). BMC Biology 7, S. 74.
- Katz, Sigrid; Waltraud Klepal, Monika Bright (2011): The Osedax Trophosome: Organization and Ultrastructure. The Biological Bulletin 220, S. 128–139.
- Eichinger, Irmgard; Waltraud Klepal, Markus Schmid, Monika Bright (2011): Organization and Microanatomy of the Sclerolinum contortum Trophosome (Polychaeta, Siboglinidae). The Biological Bulletin 220, S. 140–153.
- Worsaae, Katrine; Greg W. Rouse (2010): The simplicity of males: Dwarf males of four species of Osedax (Siboglinidae; Annelida) investigated by confocal laser scanning microscopy. Journal of Morphology 271, S. 127–142.
- Rouse, Greg W.; Nerida G. Wilson, Katrine Worsaae, Robert C. Vrijenhoek (2015): A Dwarf Male Reversal in Bone-Eating Worms. Current Biology 25, S. 236–241. doi:10.1016/j.cub.2014.11.032
- Maderspacher, F. (2015): Evolution: They Never Come Back, or Do They?. Current Biology 25, S. R62–R64. doi:10.1016/j.cub.2014.12.020
- Sumida, Paulo Y. G.; Joan M. Alfaro-Lucas, Mauricio Shimabukuro, Hiroshi Kitazato, Jose A. A. Perez, Abilio Soares-Gomes, Takashi Toyofuku, Andre O. S. Lima, Koichi Ara, Yoshihiro Fujiwara (2016): Deep-sea whale fall fauna from the Atlantic resembles that of the Pacific Ocean. Scientific Reports 6:22139. doi:10.1038/srep22139.
- Glover, Adrian G.; Helena Wiklund, Sergio Taboada, Conxita Avila, Javier Cristobo, Craig R. Smith, Kirsty M. Kemp, Alan J. Jamieson, Thomas G. Dahlgren (2013): Bone-eating worms from the Antarctic: the contrasting fate of whale and wood remains on the Southern Ocean seafloor. Proceedings of the Royal Society B 280, 20131390.
- Smith, Craig R.; Adrian G. Glover, Tina Treude, Nicholas D. Higgs, Diva J. Amon (2015): Whale-Fall Ecosystems: Recent Insights into Ecology, Paleoecology, and Evolution. Annual Review of Marine Science 7, S. 571–596.
- Smith, Craig R.; Amy R. Baco (2003): Ecology of whale falls at the deep-sea floor. Oceanography and Marine Biology 41, S. 311–354.
- Lundsten, Lonny; Kyra L. Schlining, Kaitlin Frasier, Shannon B. Johnson, Linda A. Kuhnz, Julio B.J. Harvey, Gillian Clague & Robert C. Vrijenhoek (2010): Time-series analysis of six whale-fall communities in Monterey Canyon, California, USA. Deep Sea Research Part I: Oceanographic Research Papers 57(12), S. 1573–1584.
- Salathé, Rahel M.; Robert C. Vrijenhoek (2012): Temporal variation and lack of host specificity among bacterial endosymbionts of Osedax bone worms (Polychaeta: Siboglinidae). BMC Evolutionary Biology 12, S. 189–202.
- Braby, Carmen E.; Greg W. Rouse, Shannon B. Johnson, William J. Jones, Robert C. Vrijenhoek (2007): Bathymetric and temporal variation among Osedax boneworms and associated megafauna on whale-falls in Monterey Bay, California. Deep Sea Research Part I: Oceanographic Research Papers 54(10), S. 1773–1791 doi:10.1098/rsbl.2015.0072
- Higgs, Nicholas D.; Adrian G. Glover, Thomas G. Dahlgren, Craig R. Smith, Yoshihiro Fujiwara, Florence Pradillon, Shannon B. Johnson, Robert C. Vrijenhoek, Crispin T. S. Little (2014): The morphological diversity of Osedax worm borings (Annelida: Siboglinidae). Journal of the Marine Biological Association of the United Kingdom 94(7), S. 1429–1439.
- Jones, William J.; Shannon B. Johnson, Greg W. Rouse, Robert C. Vrijenhoek (2011): Not whale-fall specialists, Osedax worms also consume fishbones. Biology letters 7(5), S. 736–739.
- Jones, William J.; Shannon B. Johnson, Greg W. Rouse, Robert C. Vrijenhoek (2008): Marine worms (genus Osedax) colonize cow bones. Proceedings of the Royal Society B 275(1633), S. 387–391.
- Fujikura, Katsunori; Yoshihiro Fujiwara, Masaru Kawato (2006): A New Species of Osedax (Annelida: Siboglinidae) Associated with Whale Carcasses off Kyushu, Japan. Zoological Science 23(8), S. 733–740.
- Rouse, Greg W.; Katrine Worsaae, Shannon B. Johnson, William J. Jones, Robert C. Vrijenhoek (2008): Acquisition of Dwarf Male “Harems” by Recently Settled Females of Osedax roseus n. sp. (Siboglinidae; Annelida). Biological Bulletin 214, S. 67–82.
- Katz, Sigrid; Greg W. Rouse (2013): The reproductive system of Osedax (Annelida, Siboglinidae): ovary structure, sperm ultrastructure, and fertilization mode. Invertebrate Biology 132(4), S. 368–385.
- Rouse, Greg W.; Nerida G. Wilson, Shana K. Goffredi, Shannon B. Johnson, Tracey Smart, Chad Widmer, Craig M. Young, Robert C. Vrijenhoek (2009): Spawning and development in Osedax boneworms (Siboglinidae, Annelida). Marine Biology 156(3), S. 395–405.
- Miyamoto, Noriyo; Tomoko Yamamoto, Yoichi Yusa, Yoshihiro Fujiwara (2013): Postembryonic development of the bone-eating worm Osedax japonicus. Naturwissenschaften 100(3), S. 285–289.
- Tresguerres, Martin; Sigrid Katz, Greg W. Rouse (2013): How to get into bones: proton pump and carbonic anhydrase in Osedax boneworms. Proceedings of the Royal Society B 280, S. 20130625.
- Huusgaard, Randi S.; Bent Vismann, Michael Kühl, Martin Macnaugton, Veronica Colmander, Greg W. Rouse, Adrian G. Glover, Thomas Dahlgren, Katrine Worsaae (2012): The Potent Respiratory System of Osedax mucofloris (Siboglinidae, Annelida) – A Prerequisite for the Origin of Bone-Eating Osedax? PLoS ONE 7(4), e35975.
- Goffredi, Shana K.; Shannon B. Johnson, Robert C. Vrijenhoek (2007): Genetic Diversity and Potential Function of Microbial Symbionts Associated with Newly Discovered Species of Osedax Polychaete Worms. Applied and Environmental Microbiology 73(7), S. 2314–2323.
- Verna, Caroline; Alban Ramette, Helena Wiklund, Thomas G. Dahlgren, Adrian G. Glover, Françoise Gaill, Nicole Dubliere (2010): High symbiont diversity in the bone-eating worm Osedax mucofloris from shallow whale-falls in the North Atlantic. Environmental Microbiology 12(8), S. 2355–2370.
- Goffredi, Shana K.; Hana Yi, Qingpeng Zhang, Jane E. Klann, Isabelle A. Struve, Robert C. Vrijenhoek, Titus Brown (2014): Genomic versatility and functional variation between two dominant heterotrophic symbionts of deep-sea Osedax worms. ISME Journal 8(4), S. 908–924.
- Goffredi, Shana K.; Victoria J. Orphan, Greg W. Rouse, Linda Jahnke, Tsegeria Embaye, Kendra Turk, Ray Lee, Robert C. Vrijenhoek (2005): Evolutionary innovation: a bone-eating marine symbiosis. Environmental Microbiology 7(9), S. 1369–1378.
- Greg W. Rouse, Shana K. Goffredi, Shannon B. Johnson and Robert C. Vrijenhoek. 2018. An Inordinate Fondness for Osedax (Siboglinidae: Annelida): Fourteen New Species of Bone Worms from California. Zootaxa. 4377(4); 451–489. DOI: 10.11646/zootaxa.4377.4.1
- Mari Heggernes Eilertsen, Thomas G. Dahlgren, Hans Tore Rapp. 2020. A New Species of Osedax (Siboglinidae: Annelida) From Colonization Experiments in the Arctic Deep Sea. Front. Mar. Sci. 7:443. doi:10.3389/fmars.2020.00443
- Glover, Adrian G.; Björn Källström, Craig R. Smith, Thomas G. Dahlgren (2005): World-wide whale worms? A new species of Osedax from the shallow north Atlantic. Proceedings of the Royal Society B 272, S. 2587–2592.
- Schander, Christoffer; Hans Tore Rapp, Thomas G. Dahlgren (2010): Osedax mucofloris (Polychaeta, Siboglinidae), a bone-eating marine worm new to Norway. Fauna norvegica 30, S. 5–8.
- Yadong Zhou, Yuan Wang, Yuanning Li, Chengcheng Shen, Zhensheng Liu, Chunsheng Wang. 2018. First report of Osedaxin the Indian Ocean indicative of trans-oceanic dispersal through the Southern Ocean Marine Biodiversity 50:4. doi:10.1007/s12526-019-01034-x
- Danise, Silvia; Nicholas D. Higgs (2015): Bone-eating Osedax worms lived on Mesozoic marine reptile deadfalls. Biology Letters 11(4): 20150072.
- Kiel, Steffen; Wolf-Achim Kahl, James L. Goedert (2011): Osedax borings in fossil marine bird bone. Naturwissenschaften 98(1), S. 51–55.
- Kiel, Steffen; Wolf-Achim Kahl, James L. Goedert (2013): Traces of the bone-eating annelid Osedax in Oligocene whale teeth and fish bones. Paläontologische Zeitschrift 87(1), S. 161–167.
- Kiel, Steffen; James L. Goedert, Wolf-Achim Kahl, and Greg W. Rouse (2010): Fossil traces of the bone-eating worm Osedax in early Oligocene whale bones. PNAS 107(19), S. 8656–8659.
- Higgs, Nicholas D.; Crispin T.S. Little, Adrian G. Glover, Thomas G. Dahlgren, Craig R. Smith, Stefano Dominici (2012): Evidence of Osedax worm borings in Pliocene (∼3 Ma) whale bone from the Mediterranean. Historical Biology 24(3), S. 269–277.
- Vrijenhoek, Robert C.; Shannon B. Johnson, Greg W. Rouse (2008): Bone-eating Osedax females and their ‘harems’ of dwarf males are recruited from a common larval pool. Molecular Ecology 17, S. 4535–4544.