Nicotinsäure-N-oxid
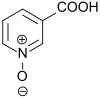
Nicotinsäure-N-oxid ist ein Derivat des Pyridin-N-Oxids, das in 3-Stellung eine Carboxygruppe trägt. Die wichtigste Verwendung von 3-Pyridincarbonsäure-1-oxid ist als Ausgangsstoff für 2-Chlornicotinsäure, die mehreren bedeutenden Arzneistoffen und Pflanzenschutzmitteln zugrunde liegt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nicotinsäure-N-oxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H5NO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelbstichig rotes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 139,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in kaltem, sehr leicht löslich in heißem Wasser, in heißem Methanol und heißem Eisessig[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
In einer kurzen Notiz wurde 1949 die Synthese von Nicotinsäure-N-oxid aus Nicotinsäure und 30 %igem Wasserstoffperoxid in Eisessig durch Erhitzen auf 100 °C für 3 h berichtet.[2]
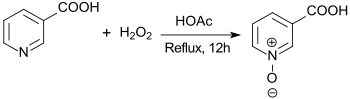
Die Reaktion liefert das Endprodukt in einer Ausbeute von 70 – 80 %.[4]
Nicotinsäure-N-oxid ist auch durch Oxidation von Nicotinsäureamid mit meta-Chlorperbenzoesäure und anschließender Hydrolyse der Amidgruppe[5] oder risikoärmer durch Oxidation von Nicotinsäuremethylester mit Carbamidperoxid UHP in Ameisensäure und anschließende Hydrolyse der Estergruppe[6] zugänglich.
Eigenschaften
Nicotinsäure-N-oxid ist ein beigefarbener Feststoff, der als Reinsubstanz in gelblichen bis weißen Nadeln kristallisiert. Die Verbindung ist in heißem Wasser und Methanol sehr leicht löslich, weniger gut in Ethanol und unlöslich in unpolaren Lösungsmitteln, wie z. B. Petrolether oder Chloroform.[2]
Anwendungen
Wichtigste Anwendung von Nicotinsäure-N-oxid ist als Vorstufe von 2-Chlornicotinsäure, die durch Umsetzung mit Phosphoroxychlorid POCl3 im Überschuss und – bezogen auf 3-Pyridincarbonsäure-1-oxid – äquimolaren Mengen der Base Triethylamin NEt3 erzeugt wird.[7]
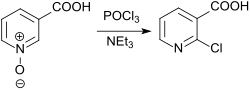
Unter den Reaktionsbedingungen wird das N-Oxid reduziert, und es werden Ausbeuten an 2-Chlornicotinsäure von 65 bis 70 % erzielt.
2-Chlornicotinsäure ist Ausgangsverbindung für das nichtsteroidale Antirheumatikum Nifluminsäure und seine metabolische Vorstufe (Prodrug) Morniflumate, für das in der Tiermedizin eingesetzte Nichtopioid-Analgetikum Flunixin und das Virustatikum Nevirapin, außerdem für die Herbizide Diflufenican und Nicosulfuron, sowie das Fungizid Boscalid.
Einzelnachweise
- Eintrag zu Nicotinic Acid N-oxide bei TCI Europe, abgerufen am 7. Januar 2020.
- G.R. Clemo, H. Koenig: Notes: The N-oxides of nicotinic acid and its esters. In: J. Chem. Soc. 1949, S. 231–232, doi:10.1039/JR949000S228.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–474.
- E.C. Taylor, Jr., A.J. Crovetti: Pyridine-1-oxides. I. Synthesis of some nicotinic acid derivatives. In: J. Org. Chem. Band 19, Nr. 10, 1954, S. 1633–1640, doi:10.1021/jo1375a012.
- D.H. Bremner, K.R. Sturrock, G. Wishart, S.R. Mitchell, S.M. Nicoll, G. Jones: A comparison of methods for N-oxidation of some 3-substituted pyridines. In: Synth. Commun. Band 27, Nr. 9, 1997, S. 1535–1542, doi:10.1080/00397919708006090.
- R. Balicki, J. Golinski: A simple and efficient method for the preparation of N-heteroaromatic N-oxides. In: Synth. Commun. Band 30, Nr. 8, 2000, S. 1529–1534, doi:10.1080/00397910008087182.
- Patent DE80209: Verfahren zur Herstellung von 2-Chlornicotinsäure. Angemeldet am 25. November 1969, veröffentlicht am 5. März 1971, Erfinder: E. Kretzschmar, H.-J. Heidrich, G. Dietz, S. Henker.
