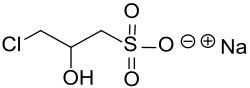
Natrium-3-chlor-2-hydroxypropansulfonat
Natrium-3-chlor-2-hydroxypropansulfonat CHPS ist ein multifunktionelles, wasserlösliches Sulfonsäuresalz, das neben einem Chloratom als Nukleofug eine sekundäre Hydroxygruppe aufweist. Wegen seiner Reaktivität besonders gegenüber (sekundären) Aminogruppen wird CHPS zur Hydrophilisierung von Aminen eingesetzt. Durch Verknüpfung mit langkettigen (CnH2n+1 mit n ≥ 8) und damit lipophilen Alkoholen oder Aminen werden grenzflächenaktive Amphiphile erzeugt. Diese Amphiphile bilden in Wasser Mizellen, Liposomen oder in hoher Konzentration lyotrope flüssigkristalline Phasen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natrium-3-chlor-2-hydroxypropansulfonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H7ClO4SNa | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196,59 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Die Synthese von Natrium-3-chlor-2-hydroxypropansulfonat aus Epichlorhydrin ECH und Natriumsulfit Na2SO3 wurde bereits 1868 von Ludwig Darmstaedter berichtet.[2]
Die exakte Konstitutionsformel der dem Natriumsalz zugrunde liegenden und von Darmstaedter so genannten Chlormethylolisäthionsäure als „1-Chlor-2-oxy-propan-sulfonsäure“ wurde jedoch erst 1935 geklärt.[3] Wegen der relativ geringen Wasserlöslichkeit des Epichlorhydrins bildet sich leicht ein ECH-Wasser-Zweiphasengemisch und Reaktionsumsatz und Ausbeute nehmen deutlich ab. Unter optimierten Bedingungen – Verwendung von Natriummetabisulfit Na2S2O5 als Hydrogensulfit HSO3--Quelle neben geringen Mengen Natriumsulfit, Sauerstoffausschluss, Methanolzusatz als internes Kühlmittel, intensive Durchmischung und konstante Reaktionstemperatur (80 °C) – kann CHPS innerhalb 30 Minuten in praktisch quantitativer Ausbeute erhalten werden.[4]
Eigenschaften
Natrium-3-chlor-2-hydroxypropansulfonat ist ein weißer, kristalliner und gut wasserlöslicher Feststoff. Das Salz kann zur Reinigung aus Wasser-Ethanol umkristallisiert werden.[5]
Anwendungen
Funktionelle Verbindungen auf CHPS-Basis
Die Reaktion von Natrium-3-chlor-2-hydroxypropansulfonat mit Ammoniak liefert 3-Amino-2-hydroxypropansulfonat[3], dessen kurzkettigen Ester antikonvulsive Eigenschaften zeigen.[6] Aus Natrium-3-chlor-2-hydroxypropansulfonat und N-(2-Hydroxyethyl)piperazin (CAS No.: 103-76-4) entsteht das entsprechende disubstituierte Piperazinsalz, das mittels Adsorption an einen auf Poly(styrol-co-divinylbenzol)sulfonsäure basierenden kationischen Ionenaustauschers in der H-Form von Nebenprodukten befreit und anschließend mit Ammoniumhydroxidlösung eluiert (desorbiert) wird.
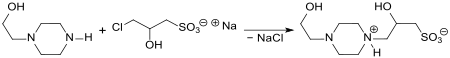
Aufarbeitung durch Ansäuern und Ausfällen liefert ein Piperazinderivat, das als physiologische Puffersubstanz (pKa 7,9 bei 20 °C) bezüglich Zelltoxizität und Einfluss auf das Zellwachstum mit den Good-Puffern HEPES und HEPPS vergleichbar ist.[7]
Reaktion von Natrium-3-chlor-2-hydroxypropansulfonat mit Chelatbildnern, wie z. B. Iminodiessigsäure IDA, erzeugt einen sehr gut wasserlöslichen und – im Gegensatz zu EDTA als Standard für Chelatliganden – bioabbaubaren Komplexbildner, der sich als Stabilisator für peroxidbasierte Bleichmittel, wie z. B. Natriumpercarbonat, in Waschmittelzubereitungen eignet.[8]
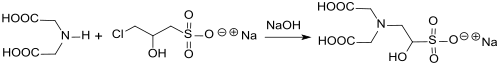
Anionische Tenside auf CHPS-Basis
So genannte Estersulfonate, z. B. durch Reaktion der C12-Carbonsäure Laurinsäure und CHPS, zeigen als Tenside vorteilhafte Eigenschaften hinsichtlich ihrer kritischen Mizellkonzentration CMC und Oberflächenspannung.[9]
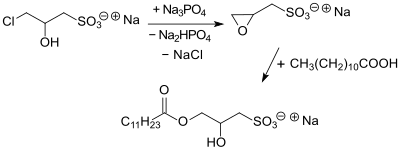
Estersulfonate sind jedoch gegen Hydrolyse im Basischen, z. B. in der Waschlauge, empfindlich – ebenso wie die oft als ökologisch besonders vorteilhafte Detergentien beschriebenen sulfonierten Fettsäuremethylester (MES). Als Alternative wurden Ester langkettiger α-tertiärer Carbonsäuren mit Natrium-3-chlor-2-hydroxypropansulfonat vorgeschlagen, die wegen der sterisch gehinderten Carbonylgruppe wesentlich hydrolysestabiler sind.[10]
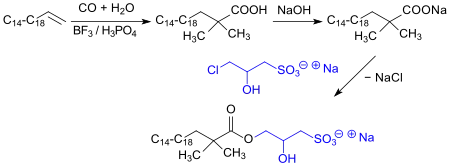
Die dafür erforderlichen tertiären Carbonsäuren sind aus langkettigen linearen α-Olefinen LAO, Kohlenmonoxid und Wasser unter Säurekatalyse herstellbar.[10] Wegen der problematischen Bioabbaubarkeit der α,α-disubstituierten Carbonsäuren fanden diese Estersulfonate keine kommerzielle Anwendung.
Amphotere Tenside auf CHPS-Basis
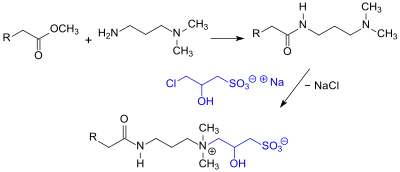
Hauptanwendung für Natrium-3-chlor-2-hydroxypropansulfonat sind zwitterionische Tenside aus der Klasse der Sulfobetaine oder Sultaine, die konventionell durch Reaktion von langkettigen sekundären Aminen mit Propan-1,3-sulton hergestellt werden. Mit dem wesentlich unproblematischeren CHPS entstehen mit Aminen 2-Hydroxypropylsultaine mit einer zusätzlichen, die Hydrophilie der Kopfgruppe verstärkenden, Hydroxygruppe.[11][12]
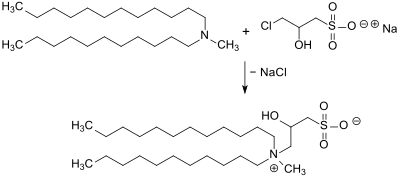
Die langkettigen Hydroxysultaine sind mit anionischen, nichtionischen und kationischen Tensiden verträglich und daher nützliche Sekundärtenside, die zusammen mit einem anionischen Haupttensid zur Viskositätserhöhung und insbesondere als Schaumbildner in milden Seifen und Shampoos eingesetzt werden. Hauptsächlich handelt es sich dabei um das auf natürlicher Laurinsäure basierende und mit Cocoamidopropylbetain verwandte Tensid Cocamidopropyl hydroxysultaine (INCI), das u. a. von den Spezialchemiefirmen Kaō als BETADETR SHR, Stepan Company als AMPHOSOLR CS-50, Croda International als CrodatericTM CAS 50 und von Colonial Chemical als ColaRteric CHGL vermarktet wird. Hydroxysultaine zeigen auch in der tertiären Ölgewinnung (engl. enhanced oil recovery, EOR) vorteilhafte Eigenschaften.[13]
Bolaamphiphile mit Sultainstrukturen an beiden Enden der hydrophoben Kette sind ebenfalls beschrieben.[5]
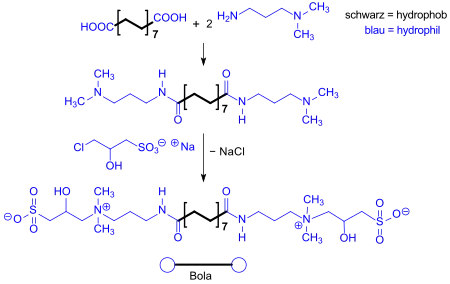
Amphotere Tenside dieses Typs weisen ausgezeichnete Dispergiereigenschaften für Kalkseifen auf.
Gemini-Tenside auf CHPS-Basis
Als Geminitenside – von lateinisch gemini = Zwillinge – werden grenzflächenaktive Verbindungen bezeichnet, die formal aus zwei miteinander verknüpften konventionellen Tensidmolekülen („Bis-Tenside“) bestehen und sich durch außergewöhnliche Eigenschaften, u. a. sehr niedrige kritische Mizellkonzentrationen und hocheffiziente Reduzierung der Luft/Wasser-Oberflächenspannung und Öl/Wasser-Grenzflächenspannung auszeichnen.[14][15]
Einbau von zwei Hydroxypropylsulfonatgruppen mittels Natrium-3-chlor-2-hydroxypropansulfonat bedingt drastisch höhere Hydrophilie und wegen der geringen elektrostatischen Abstoßung der amphiphilen Kopfgruppen deutlich kompaktere Molekülanordnung an Grenzflächen und dadurch außerordentlich niedrige Öl/Wasser-Grenzflächenspannung (10−3mN/m bei Tensidkonzentrationen < 0,5 % Gewichtsprozent).[16]
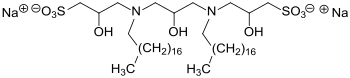
Natrium-3-chlor-2-hydroxypropansulfonat CHPS ist ein einfach zugängliches, als kristalliner Feststoff gut handhabbares und im Vergleich zu dem flüssigen, giftigen und krebserzeugendem Propan-1,3-sulton wesentlich sichereres Reagens zur Einführung der außerordentlich hydrophilen 2-Hydroxypropansulfonsäure-Gruppe in langkettige Carbonsäuren, Alkohole und Amine unter Bildung amphiphiler Estersulfonate, Ethersulfonate bzw. (Hydroxy)Sultaine.
Literatur
- Eric G. Lomax, Hrsg.: Amphoteric Surfactants, 2nd edit., Marcel Dekker, Inc., New York, 1996, ISBN 0-8247-9392-7.
- Horst Stegemeyer, Hrsg.: Lyotrope Flüssigkristalle: Grundlagen, Entwicklung, Anwendung, Steinkopff, Heidelberg, 1999, ISBN 978-3-642-63695-0.
- Douglas Hayes, Daniel Solaiman, Richard Ashby, Hrsg.: Biobased Surfactants: Synthesis, Properties, and Applications, Academic Press and AOCS Press, 2019, ISBN 978-0-128-12705-6.
Einzelnachweise
- Datenblatt Sodium 3-chloro-2-hydroxypropanesulphonatehemihydrate bei AlfaAesar, abgerufen am 12. Juli 2020 (PDF) (JavaScript erforderlich).
- L. Darmstaedter: Ueber die relative Constitution und einige Metamorphosen des Epichlorhydrins. In: Liebigs Ann. Chem. Band 148, Nr. 1, 1868, S. 119–131, doi:10.1002/jlac.18681480112.
- S. Tsunoo: Darstellung von Amino-oxy-propan-sulfonsäure und ihren Derivaten. In: Ber. Dtsch. Chem. Ges. Band 68, Nr. 7, 1935, S. 1334–1341, doi:10.1002/cber.19350680721.
- Patent US3239560: Method for preparation of halide hydroxysulfonate. Angemeldet am 5. März 1962, veröffentlicht am 8. März 1966, Anmelder: The Procter & Gamble Co., Erfinder: C.M. Cambre, K.W. Theile.
- T. Takeda, S. Yamamura, K. Honda, T. Tsujisaki, M. Nakamura, K. Horikawa: Synthesis and properties of α,ω-bis(amidopropyl-hydroxysulfobetaine)-type amphoteric surfactants. In: J. Jpn. Chem. Soc. Band 39, Nr. 8, 1990, S. 576–579, doi:10.5650/jos1956.39.8_576.
- Patent EP0309421B1: O-alkanoyl derivatives of 3-amIno-2-hydroxypropanesulfonIc acid having anticonvulsivant activity and pharmaceutical compositions containing same for the therapeutical treatment of epilepsy. Angemeldet am 19. September 1988, veröffentlicht am 19. November 1992, Anmelder: SIGMA TAU Industrie Farmaceutiche Riunite S.p.A., Erfinder: C.A. Bagolini, L. Pacifici, E.T. Ouaresima.
- Patent US4246194: Amino-hydroxy-alkyl sulfonic acid-zwitterions. Angemeldet am 27. August 1979, veröffentlicht am 20. Januar 1981, Anmelder: Research Organics, Inc., Erfinder: W.J. Ferguson.
- Patent EP0516102B1: Degradable chelants having sulfonate groups, uses and compositions thereof. Angemeldet am 27. Mai 1992, veröffentlicht am 10. Mai 1995, Anmelder: The Dow Chemical Co., Erfinder: D.K. Crump, D.A. Wilson.
- Y. Hao, D. Yuan, Y. Wang, Y. Qi, R. Zhang: Synthesis and properties of lauric acid-2-hydroxy-3-propane sulfonic acid sodium salt. In: Asian J. Chem. Band 26, Nr. 14, 2014, S. 4449–4451, doi:10.14233/ajchem.2014.16950.
- Patent US3097218: Sulfonates of hydroxy alkyl esters of tertiary alkanoic acids. Angemeldet am 14. Dezember 1961, veröffentlicht am 9. Juli 1963, Anmelder: Shell Oil Co., Erfinder: P.L. Kooijman, H. Buesink.
- N. Parris, J.K. Well, W.M. Linfield: Soap-based detergent formulations: XII. Alternate syntheses of surface active sulfobetaines. In: J. Amer. Oil Chem. Soc. Band 53, Nr. 2, 1976, S. 60–63, doi:10.1007/BF02637393.
- N. Parris, C. Pierce, W.M. Linfield: Soap-based detergent formulations: XXIV. Sulfobetaine derivatives of fatty amides. In: J. Amer. Oil Chem. Soc. Band 54, Nr. 7, 1977, S. 294–296, doi:10.1007/BF02671099.
- C. Shi, S. Song, H. Ren, Q. Zeng, X. Tang: Synthesis of didodecylmethyl hydroxyl sulfobetaine and its evaluation for alkali-free flooding. In: J. Petrol Explor. Prod. Technol. Band 5, 2014, S. 219–224, doi:10.1007/s-13202-014-0148-4.
- F.M. Menger, C.A. Littau: Gemini surfactants: Synthesis and properties. In: J. Am. Chem. Soc. Band 113, Nr. 4, 1991, S. 1451–1452, doi:10.1002/ja00004a077.
- F.M. Menger, J.S. Keiper: Gemini-Tenside. In: Angew. Chem. Band 112, Nr. 11, 2000, S. 1980–1996, doi:10.1002/1521-3757(20000602)112:11<1980::AID-ANGE1980>3.0.CO;2-D.
- M. Mpelwa, S. Tang, L. Jin, R. Hu: New sulfonate gemini surfactants: synthesis and evaluation for enhanced oil recovery. In: J. Disp. Sci. Technol. 2019, S. 1451–14, doi:10.1080/01932691.2019.1652189.
