Propan-1,3-sulton
Propan-1,3-sulton ist eine chemische Verbindung aus der Stoffgruppe der Sultone. Es kann als innerer, cyclischer Ester der γ-Hydroxypropansulfonsäure gesehen werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
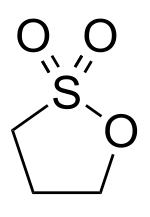 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propan-1,3-sulton | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O3S | ||||||||||||||||||
| Kurzbeschreibung |
farblose, kristalline Masse[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
96 °C (1,3 hPa)[1] | ||||||||||||||||||
| Dampfdruck |
0,48 Pa (20 °C)[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung
Die Synthese der Verbindung erfolgt in zwei Schritten. Im ersten Schritt wird durch eine radikalische Addition von Natriumhydrogensulfit an Allylalkohol in Gegenwart von Luftsauerstoff oder von Peroxiden als Initiatoren Natrium-3-hydroxypropansulfonat hergestellt. Die Zielverbindung erhält man im zweiten Schritt durch saure Dehydratisierung der Zwischenverbindung.[1] Eine weitere Synthese startet mit einer Reed-Reaktion mit n-Propylchlorid, Chlor und Schwefeldioxid. Das resultierende γ-Chlorpropansulfonsäurechlorid wird zur freien Säure hydrolysiert und anschließend unter Chlorwasserstoffabgabe zyklisiert.[3]
Eigenschaften
Propan-1,3-sulton ist eine farblose, kristalline Masse, die bei 31 °C schmilzt. Die Verbindung kann nur unter reduziertem Druck verdampft werden. In der Hitze erfolgt die Zersetzung der Substanz.[2]
| Siedetemperaturen unter reduziertem Druck[3] | ||||||||||||
| Druck | in mbar | 1,33 | 6,67 | 13,32 | 40 | |||||||
| Siedetemperatur | in °C | 100 | 134 | 150 | 180 | |||||||
In Wasser ist die Verbindung nur gering löslich. Bei 25 °C lösen sich 0,025 mol%, bei 70 °C 0,062 mol% in Wasser.[3] Umgekehrt lösen sich bei 25 °C 0,75 mol%, bei 70 °C 0,475 mol% Wasser in Propan-1,3-sulton.[3] In Wasser erfolgt eine langsame Hydrolyse, die sich mit zunehmender Temperatur beschleunigt.[3] Als Produkt der Reaktion mit Wasser entsteht 3-Hydroxypropansulfonsäure.
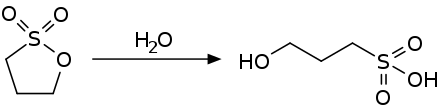
Die Hydrolysereaktion kann bei Wasserüberschuss als Reaktion erster Ordnung gesehen werden, deren Halbwertszeiten bezüglich der Propan-1,3-sultonkonzentration bestimmt worden sind.[3][7]
| Hydrolysegeschwindigkeit[3][7] | ||||||||||||
| Temperatur | in °C | 20 | 30 | 40 | 70 | |||||||
| Halbwertszeit | in h | 14,8 | 4,8 | 1,6 | 0,11 | |||||||
Die Umsetzung der Verbindung mit Alkoholen oder Alkoholaten ergibt die entsprechenden 3-Alkoxypropansulfonsäuren.[3] Propan-1,3-sulton wirkt gegenüber vielen Stoffen als Alkylierungsmittel. So werden mit Harnstoff oder Thioharnstoff die O- bzw. S-alkylierten Produkte gebildet. Mit Carbonsäuren resultieren 3-Sulfopropylester. In Gegenwart von Aluminiumchlorid gelingt die Friedel-Crafts-Alkylierung von Aromaten.[3]
Toxikologische Eigenschaften
Eine akute Vergiftung zeichnet sich im Tierversuch durch Apathie, zunehmende Atemnot, blutige Durchfälle, Tremor und Krämpfe aus.[8] Der Tod trat Stunden bis Tage nach einer akuten Vergiftung durch Lungenödeme, schwerste Darmblutungen und Hirnödeme auf.[8] LD50-Werte sind für die orale Aufnahme an der Ratte (157-350 mg/kg KG) und für die intravenöse Gabe (210 mg/kg KG) beschrieben.[8]
In einer Vielzahl von Mutagenitätstests erwies es sich als mutagen.[8] Es ist eindeutig kanzerogen und induziert lokale sowie systemische Tumore.[8]
Verwendung
Die Verbindung kann zur Herstellung von Polyethersulfonen und speziellen, zwitterionischen Polymeren verwendet werden.[1] Zudem ist sie Bestandteil von Batterieelektrolyten und photographischen Materialien.[1] In der organischen Chemie wird sie Ausgangsverbindung für die Synthese von Sultainen, Sulfobetainen, Heterocyclen und anderen sulfonylfunktionalisierten Verbindungen genutzt.[1]
Gesundheitsgefahren
Propan-1,3-sulton ist nach REACH als besonders gefährlicher krebserzeugender Stoff eingestuft und darf nur in geschlossenen Anlagen hergestellt oder verwendet werden.[6]
Einzelnachweise
- Eintrag zu Propan-1,3-sulton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Eintrag zu 1,3-Propansulton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Fischer, R.F.: Propanesultone. In: Ind. Eng. Chem. 56 (1964) 41–45, doi:10.1021/ie50651a008.
- Eintrag zu 1,3-propanesultone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt 1,3-Propansulton bei Sigma-Aldrich, abgerufen am 25. Januar 2020 (PDF).
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. August 2016.
- Bordwell, F.G.; Osborne, E.; Chapman, D.: The Hydrolysis of Sultones. The Effect of Methyl Groups on the Rates of Ring-opening Solvolyses in J. Am. Chem. Soc. 81 (1959) 2698-2705, doi:10.1021/ja01520a029.
- Manfred Metzler, Frank J. Hennecke: Toxikologie für Naturwissenschaftler und Mediziner Stoffe, Mechanismen, Prüfverfahren. 3., überarb. und aktualisierte Auflage. Weinheim 2005, ISBN 978-3-527-30989-4, S. 267–268.


