Lycopin
Lycopin, auch Lycopen oder Leukopin gehört zur Klasse der Carotinoide und wird in hohen Konzentrationen in Tomaten – von deren wissenschaftlichem Namen Solanum lycopersicum auch die Bezeichnung des Stoffes herrührt – und Hagebutten gefunden. Der Stoff gehört zu den Tetraterpenen und besitzt aufgrund seiner Polyen-Struktur eine rote Farbe, welche auch den Tomaten ihre charakteristische Färbung verleiht. Es ist als Lebensmittelfarbstoff E 160d in der EU zugelassen. Lycopin zählt zu den Antioxidantien und gilt als Radikalfänger, d. h., es kann bestimmte reaktionsfreudige Moleküle im menschlichen Körper unschädlich machen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | Lycopin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C40H56 | |||||||||||||||||||||
| Kurzbeschreibung |
dunkelrote Nadeln[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 536,85 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Lycopin ist ein lineares, acyclisches Polyen, das zur Gruppe der Carotine in der Klasse der Carotinoide gehört. Es hat 13 Doppelbindungen, davon liegen 11 konjugiert vor. Methylgruppen liegen an den Positionen 2, 6, 10, 14 sowie gespiegelt an 2', 6', 10' und 14' vor. Die vielen konjugierten Doppelbindungen verleihen Lycopin eine rubinrote Farbe. In Hexan beträgt das Absorptionsmaximum 472 nm.[6] Wegen seines stark hydrophoben Charakters ist Lycopin in Wasser, Ethanol oder Methanol nahezu unlöslich, dagegen gut in Chloroform, Benzol, Hexan, Aceton oder in anderen organischen Lösungsmitteln.
Lycopin ist licht-, wärme-, sauerstoff- und säureempfindlich. Metallionen wie Cu(II) oder Fe(III) katalysieren seine Oxidation.[6]
Bedeutung
Lycopin ist eines der am weitesten verbreiteten natürlichen roten Pigmente und wird ausschließlich von Pflanzen, Pilzen sowie Mikroorganismen synthetisiert.[6] In Pflanzen absorbiert es mit anderen Carotinoiden Licht für die Photosynthese und schützt Chlorophyllmoleküle vor Oxidationsschäden durch Licht und Sauerstoff.
In grünem Gemüse oder in (grünen) Blättern wird die natürliche Farbe des Lycopins durch grüne Pigmente (z. B. Chlorophylle) maskiert.[6] Wenn während der Reifung diese Chlorophyllmoleküle abgebaut werden, tragen Lycopin und die verbleibenden Carotinoide zu den leuchtenden Farben in Früchten (Orange, Tomate, Paprika, Erdbeere) aber auch vielen Blüten bei.
Vorkommen und Gewinnung
Lycopin wurde 1876 von Pierre-Marie Alexis Millardet in Tomaten als rotes Pigment entdeckt.[7] Die Namensgebung erfolgte aufgrund des lateinischen Namens der Tomate (Lycopersicon esculentum) 1903 durch C. A. Schunck.
Reife Tomaten haben in der Regel einen Lycopinanteil von ca. 3 bis 5 mg pro 100 g Frucht, der Lycopinanteil hängt allgemein von der Sorte und den Bedingungen des Reifeprozesses ab.[6] Auch Wassermelonen können etwa diese Konzentration an Lycopin (bis zu 100 ppm) enthalten, was auch die Farbe ihres Fruchtfleisches ausmacht[8]




Wesentlich mehr Lycopin enthalten Dosentomaten mit ca. 10 mg pro 100 Gramm, da sie meist erst in reifem Zustand geerntet werden. Konzentriertes Tomatenmark enthält sehr hohe Lycopinkonzentrationen (ca. 62 mg Lycopin pro 100 Gramm). Der Rote Gitterling (Clathrus ruber) verdankt seine rote Farbe ebenfalls Carotinoiden, an erster Stelle dem Lycopin.[9]
Die Verfügbarkeit von Lycopin ist bei verarbeiteten und erhitzten Produkten (z. B. Tomatensaft) höher als bei rohen, da beim Erhitzen die pflanzlichen Zellstrukturen aufgebrochen werden und das Lycopin herausgelöst wird. Eine deutliche Resorptionssteigerung wird durch die Kombination mit Fett erreicht. Großtechnisch wird Lycopin mit organischen Lösungsmitteln (Hexan, Dichlormethan, Methanol) aus Tomatenkonzentraten extrahiert.
Bis auf wenige Ausnahmen liegt in Früchten und Gemüse das all-trans-Isomer (auch all-E-Isomer) am häufigsten vor (94–96 % in Tomaten), es ist auch thermodynamisch die stabilste Form.[7] Dagegen dominiert in der Aprikose das cis-Isomer (7Z,9Z)-Lycopin mit 53 %, während das all-trans-Isomer zu 8 % vorhanden ist.[10] In ausgereiften Tomaten wird Lycopin in Chromoplasten als nadelförmige Kristalle gespeichert oder tief eingebettet in der Membran.
Kommerzielle Verwendung
Lycopin wird als rote Lebensmittelfarbe als Carotinoid deklariert (siehe auch Carotine (E 160a–160f)) und zur Koloration von Lebensmitteln verwendet. Es wird vor allem zur Färbung von Suppen und Soßen eingesetzt.
Metabolismus
Aufnahme
Aufgrund ihres stark hydrophoben Charakters können sich Carotinoide wie Lycopin nicht ohne Amphiphilie in Wasser lösen.[11] Im Dünndarm vermitteln daher die während des Verdauungsvorganges bereitgestellten Lipide, Gallensalze und im Gallensaft vorhandenen Phospholipide einen Einschluss in Lipidmizellen bzw. Chylomikronen. Je besser Lycopin in Mizellen eingeschlossen und damit in die Bürstensaummembran aufgenommen werden kann, desto höher ist die Bioverfügbarkeit. Der größte Teil wird jedoch ausgeschieden (etwa 70–90 %).[7] Die Aufnahme der Mizellen bzw. Chylomikronen erfolgt durch passive Diffusion. Aus Tierstudien geht hervor, dass der Mensch Carotinoide selektiver aufnimmt als zum Beispiel Mäuse.[11] Daher muss neben der passiven Diffusion auch ein anderer Mechanismus der Absorption vorliegen. Es gibt Hinweise darauf, dass Lycopin durch ein Scavenger-Rezeptorenklasse B Typ 1-Protein (SR-BI bzw. auch als SR-B1 bezeichnet) aktiv aufgenommen wird. Lycopin gelangt anschließend in das Lymphsystem.[11]
Im Blutkreislauf hat Lycopin eine Halbwertszeit von 2–3 Tagen, und liegt als Isomerengemisch vor (41–50 % als cis-Isomer).[7][10] Unter den cis-Isomeren hat dabei den größten Anteil das (5Z)-Isomer. Im Blut bei mit trans-Lycopin gefütterten Mäusen ließ sich ebenfalls das cis-Isomer nachweisen, so dass eine cis-trans-Isomerisierung im Metabolismus erfolgen muss. Durch das Blut gelangt Lycopin in verschiedene Organe und Gewebe, die höchsten Konzentrationen liegen in den Hoden, den Nebennieren, der Leber und der Prostata vor. Es ist auch neben anderen Oxidationsprodukten in der Muttermilch und anderen Körperflüssigkeiten nachgewiesen worden.
Abbau
Im Menschen wird Lycopin mithilfe der β-Carotin-Dioxygenase 2 (auch als β-β-9'-10'-Carotin-Dioxygenase 2[12], BCDO2, BCO2[13]) abgebaut.[14] Das mitochondriale Enzym wird größtenteils in der Leber und den Hoden exprimiert und spaltet das cis-Isomer in apo-10'-Lycopinal.[15] Dieses kann dann entweder zur Säure oder zum Alkohol verstoffwechselt werden.[15]
Biologische Wirkung
Carotinoide, insbesondere das Lycopin, zählen zu den wirksamsten natürlich vorkommenden Quenchern für Singulettsauerstoff 1O2. Dieser wird zum Beispiel durch photochemische Reaktionen bei der Lichtabsorption gebildet und ist hochreaktiv. In der Photosynthese spielen Carotine wie Lycopin daher eine wichtige Rolle als Pigment in Pflanzen, photosynthetische Bakterien, Pilze oder Algen. Sie schützen den Photosyntheseapparat vor starken Lichtschäden und sind ein Intermediat bei der Biosynthese wichtiger Carotinen und Xanthophylle.
Singulettsauerstoff kann verschiedene Aminosäuren in Proteinen, Nukleinsäuren sowie ungesättigte Fettsäuren oxidieren. Bei der Quenchingreaktion gehen die Carotinoide in einen angeregten Triplettzustand über (1O2 + 1Car → 3O2 + 3Car). Ihren Grundzustand erreichen die Carotinoide durch Abgabe von Wärme wieder (3Car → 1Car + Wärme). Die Carotinoidmoleküle werden also bei dieser Reaktion nicht chemisch umgewandelt und stehen somit für weitere Quenchingprozesse zur Verfügung. Aus in-vitro-Messungen geht hervor, dass die Quenchingrate Lycopins besonders hoch ist (ca. doppelt so groß wie bei β-Carotin und 100-mal so groß wie bei α-Tocopherol).[16] Diese im Labor gefundene antioxidative Wirkung bedeutet jedoch nicht automatisch eine gesundheitsfördernde Wirkung des Lycopin. Darüber hinaus fängt Lycopin, wie auch andere Carotinoide, schädliche freie Radikale (Stickstoffdioxid-, Thiyl-Sulphonylradikale oder auch ROS (z. B. O2+-)) ab und macht diese damit unschädlich.[17][18]
Es gab Hinweise, dass der Konsum von Lycopin zu einem reduzierten Risiko führt, an Herz-Kreislauf-Erkrankung, Krebs (vor allem Prostatakrebs),[19] Diabetes mellitus, Osteoporose und Unfruchtbarkeit zu leiden.[20] Eine neuere, große Studie mit ca. 28.000 Probanden lässt jedoch vermuten, dass kein Zusammenhang zwischen Lycopin und Krebsrisiko besteht.[21] Eine schützende Wirkung bei Belastungsasthma konnte nicht gezeigt werden.[22]
Prostatakrebs
Lycopin häuft sich neben anderen sekundären Metaboliten der Tomate (beispielsweise Polyphenole oder andere Carotinoide) in der Prostata an.[23] Ob diese aber gegen Prostatakrebs für sich alleine oder synergetisch wirksam sind, ist nicht bekannt. Eine in-vitro-Studie (2012) zeigte, dass Lycopin die Anbindung bestimmter Krebszellen an die Blutversorgung hemmen und damit ein Wachstum verhindern kann.[24] 2016 lagen Ergebnisse von sechs klinischen Prüfungen vor, die untersucht hatten, ob Lycopin vor einer Tumorresektion oder während einer adjuvanten Chemotherapie den PSA-Wert (prostataspezifisches Antigen) bzw. die Prostata-Inzidenz beeinflussen. Jedoch lassen sich wegen der unterschiedlichen Ergebnisse keine generelle Aussagen schlussfolgern.[23] Für kastrationsresistente Prostatakarzinome konnte bisher kein klinischer Nutzen gezeigt werden. Das DKFZ warnt auch vor Beispielen in der Werbung, deren Wirksamkeit nicht belegt ist.[25]
Ob es einen Zusammenhang gibt zwischen Verzehr von Produkten aus Tomaten und einer möglichen assoziierten Senkung des Prostatakrebsrisikos, ist noch Gegenstand der Forschung.[26] Hierfür wurden zwar viele Studien durchgeführt, die Ergebnisse lassen sich aber kontrovers deuten. So liegen Studien vor, die das Risiko durch Verzehr von Produkten aus Tomaten gesenkt sehen. Bei anderen Studien können sich dagegen keine signifikanten Schlussfolgerungen ableiten lassen. Eine Studie zeigt sogar, dass der Verzehr von Tomaten das Auftreten von Prostatakrebs begünstigt. Bei einer Ende 2016 durchgeführten Meta-Analyse über 24 analysierten Studien kamen die Autoren zum Ergebnis, dass man noch keine konkreten Aussagen treffen könne.[26] Dies liegt daran, dass die untersuchten Kohortenstudien und Studien mit hoher Qualität keine signifikanten Ergebnisse ergeben haben. Die übrigen Studiendaten können so interpretiert werden, dass der Verzehr von Tomaten mit einem reduzierten Erkrankungsrisiko bei Asiaten und Menschen aus Ozeanien einhergeht, nicht jedoch bei Menschen aus anderen Teilen der Welt.
Herz-Kreislauf-Erkrankungen
Die tägliche Einnahme von 7 mg Lycopin hat in einer placebokontrollierten Studie (2014) bei Patienten mit Herz-Kreislauf-Erkrankungen die endotheliale Dysfunktion verbessert. Bei Gesunden war kein Effekt erkennbar.[27][28]
Biosynthese
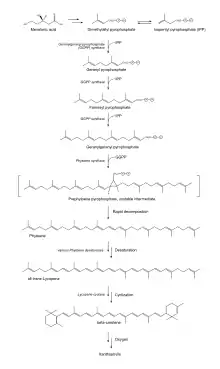
Lycopin wird in grünen Pflanzen und Cyanobakterien gebildet, der dabei genutzte Stoffwechselweg verläuft ähnlich.[29] Die Synthese startet mit Mevalonsäure, die zu Dimethylallylpyrophosphat umgesetzt wird. Diese kondensiert mit drei Molekülen von Isopentenylpyrophosphat zu Geranylgeranylpyrophosphat. Zwei Moleküle Geranylgeranylpyrophosphat werden dann verbunden zu Phytoen. Ausgehend von Phytoen wird dann über mehrere Zwischenstufen Lycopin gebildet. In Bakterien wird das all-trans-Lycopin durch ein einziges Enzym, der Phytoen-Desaturase (CRTI), hergestellt, dabei werden die Bindungen an den Positionen 7, 11, 11' und 7' dehydrogeniert.[30] Cyanobakterien, grüne Algen und Pflanzen benötigen für die Biosynthese dagegen vier Enzyme, was man als den Poly-Cis-Stoffwechselweg bezeichnet. Hierbei unterläuft das Substrat mehrfache Dehydrogenierungen und Isomerisierungen, die durch zwei Desaturasen (Pflanzentyp Phytoendesaturase PDS und ζ-Carotindesaturase ZDS) sowie zwei Isomerasen (15-cis-ζ-Carotin-Isomerase Z-ISO und Carotin-cis-trans-Isomerase CRTISO) katalysiert werden.
Lycopin könnte dann weiter über β-Carotin zu verschiedenen Xanthophyllen prozessiert werden.
Literatur
- Deutsches Ärzteblatt: Tomaten und Ketchup schützen vor Prostatakrebs, 5. September 2014.
- Der Einfluss von Lycopin auf die Endothelfunktion postmenopausaler Frauen, Sonja Schmidt, Dissertation, 2016.
Weblinks
Einzelnachweise
- Eintrag zu CI 75125 in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- Eintrag zu E 160d: Lycopene in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- Eintrag zu Lycopin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Christina Chai, W.L.F. Armarego: Purification of Laboratory Chemicals. Elsevier, 2003, ISBN 978-0-08-051546-5, S. 593 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Lycopene, ≥98% (HPLC), from tomato bei Sigma-Aldrich, abgerufen am 8. Februar 2019 (PDF).
- J. Shi und M. Le Maguer: Lycopene in tomatoes: chemical and physical properties affected by food processing. In: Critical Reviews in Food Science and Nutrition. Band 40, Nr. 1, 1. Januar 2000, S. 1–42, doi:10.1080/10408690091189275, PMID 10674200.
- Emmanouil H. Papaioannou et al.: Natural Origin Lycopene and Its “Green” Downstream Processing. In: Critical Reviews in Food Science and Nutrition. Band 56, Nr. 4, 11. März 2016, S. 686–709, doi:10.1080/10408398.2013.817381, PMID 25671774.
- .Perkins-Veazie P, Collins JK, Davis AR, Roberts W.: Carotenoid content of 50 watermelon cultivars. In: Journal of Agricultural and Food Chemistry. Band 54, Nr. 7, 2006, S. 2593–7, doi:10.1021/jf052066p.
- John Webster and Roland W.S. Webster: Introduction to Fungi, S. 591, Third Edition, 2007, Cambridge University Press.
- Joseph Schierle et al.: Content and isomeric ratio of lycopene in food and human blood plasma. In: Food Chemistry. Band 59, Nr. 3, S. 459–465, doi:10.1016/s0308-8146(96)00177-x.
- Akihiko Nagao: Absorption and metabolism of dietary carotenoids. In: BioFactors (Oxford, England). Band 37, Nr. 2, 1. März 2011, S. 83–87, doi:10.1002/biof.151, PMID 21488131.
- Binxing Li et al.: Inactivity of human β,β-carotene-9',10'-dioxygenase (BCO2) underlies retinal accumulation of the human macular carotenoid pigment. In: Proceedings of the National Academy of Sciences. Band 111, Nr. 28, 15. Juli 2014, S. 10173–10178, doi:10.1073/pnas.1402526111, PMID 24982131.
- BCO2 beta-carotene oxygenase 2, NCBI-Datenbank.
- Kiefer et al.: Identification and characterization of a mammalian enzyme catalyzing the asymmetric oxidative cleavage of provitamin A. J. Biol. Chem. 276/-/2001: 14110–14116, PMID 11278918.
- Xiang-Dong Wang: Lycopene metabolism and its biological significance. In: The American Journal of Clinical Nutrition. Band 96, Nr. 5, 1. November 2012, S. 1214S–22S, doi:10.3945/ajcn.111.032359, PMID 23053559.
- Paolo Di Mascio et al.: Carotenoids, tocopherols and thiols as biological singlet molecular oxygen quenchers. In: Biochemical Society Transactions. Band 18, Nr. 6, 1. Dezember 1990, S. 1054–1056, doi:10.1042/bst0181054, PMID 2088803.
- Avoxa – Mediengruppe Deutscher Apotheker GmbH: Pharmazeutische Zeitung online: Radikalfänger aus Tomaten und Möhren. Abgerufen am 3. Mai 2017.
- A. Mortensen et al.: Comparative mechanisms and rates of free radical scavenging by carotenoid antioxidants. In: FEBS letters. Band 418, Nr. 1–2, 24. November 1997, S. 91–97, PMID 9414102.
- Giovannuci, E. et al. (2002): A Prospective Study of Tomato Products, Lycopene and Prostate Cancer Risk. In: J Natl Cancer Inst Bd. 94, S. 391–398, PMID 11880478.
- Bowen P. et al.: Tomato sauce supplementation and prostate cancer: lycopene accumulation and modulation of biomarkers of carcinogenesis. In: Experimental Biology and Medicine. 227, Nr. 10, 2002, S. 886–893. doi:10.1177/153537020222701008. PMID 12424330.
- American Association for Cancer Research: No Magic Tomato? Study Breaks Link between Lycopene and Prostate Cancer Prevention, Science Daily. 17. Mai 2007.
- B. Falk et al.: Annals of Allergy, Asthma & Immunology. 94, Nr. 4, 2005, S. 480–485.
- Hussain SS. et al.: Food-based natural products for cancer management: Is the whole greater than the sum of the parts?. In: Seminars in Cancer Biology. 40–41, 2016, S. 233–246. doi:10.1016/j.semcancer.2016.06.002. PMID 27397504.
- Tomato nutrient may intercept cancer growth. (Memento des Originals vom 17. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Newsmeldung vom 1. Februar 2012 der University of Portsmouth.
- Prostatakrebs: Risikofaktoren und Vorbeugung – Wenige Auslöser bekannt, Informationsportal des DKFZ, abgerufen am 23. Januar 2016.
- Xu, X. et al.: Tomato consumption and prostate cancer risk: a systematic review and meta-analysis.. In: Sci Rep.. 6, Nr. 37091, 2016, S. 1–8. doi:10.1038/srep37091. PMID 27841367.
- Parag R. Gajendragadkar et al.: Effects of Oral Lycopene Supplementation on Vascular Function in Patients with Cardiovascular Disease and Healthy Volunteers: A Randomised Controlled Trial. In: PLoS ONE. 9, 2014, S. e99070, doi:10.1371/journal.pone.0099070.
- aerzteblatt.de: „Tomatenpille“ soll Gefäßfunktion verbessern, 10. Juni 2014.
- Claudia Stange: Carotenoids in Nature – Biosynthesis, Regulation and Function. Springer, Cham 2016, ISBN 978-3-319-39124-3, S. 45.
- Alexander R. Moise et al.: Mechanistic aspects of carotenoid biosynthesis. In: Chemical Reviews. Band 114, Nr. 1, 8. Januar 2014, S. 164–193, doi:10.1021/cr400106y, PMID 24175570, PMC 3898671 (freier Volltext).