Lepidurus apus
Lepidurus apus, im Deutschen manchmal als Schuppenschwanz, Frühlings-Kiemenfuß, Frühjahrs-Rückenschaler, Frühjahrs-Schildkrebs, Kieferfuß oder Kleiner Rückenschaler bezeichnet, ist eine kosmopolitisch verbreitete Art der Kiemenfußkrebse, genauer der Rückenschaler. In Mitteleuropa ist sie neben Triops cancriformis die einzige vorkommende Art. Da Lepidurus apus geringere Temperaturen bevorzugt als Triops cancriformis, ist er hier früher im Jahr zu finden. Durch das temperaturbedingt unterschiedliche zeitliche Auftreten wird eine Konkurrenz der beiden Arten vermieden.
| Lepidurus apus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Lepidurus apus | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Lepidurus apus | ||||||||||||
| (Linnaeus, 1758) |
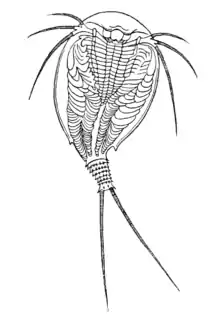

Merkmale
Die Art wird inklusive Schwanzfäden meist 42–59 mm lang, es finden sich jedoch auch kleinere Individuen, die nur 25 mm lang sein können. Vorne am Körper befindet sich der große Carapax, der im Schnitt 19 mm lang ist und etwa zwei Drittel des Abdomens verdeckt. Der flache Carapax ist fleckig bis meliert gemustert und von dunkelgelber bis bräunlicher Farbe, wobei die Seiten heller sind als die Mitte der Oberseite. Bei manchen Populationen kann der Carapax auch grünlich oder rötlich erscheinen. Auf ihm befindet sich ein einzelnes Paar Facettenaugen, die im vorderen Bereich und nahe beieinander liegen. Hinter und teilweise unter dem Carapax befindet sich das Abdomen, das aus 26–29 Körperringen besteht. Am vorderen Abdomen sitzen dabei ein bis drei Paare von Fühlern. Am letzten Körperring befinden sich die beiden langen Schwanzfäden sowie ein schwänzchenartiger Vorsprung zwischen diesen. Dieser kann als Unterscheidungsmerkmal zur Gattung Triops dienen, da dieser Vorsprung bei Triops fehlt. Auf der Unterseite befinden sich 35–48 Schwimmbeinpaare. Nur 4–6 der Körperringe tragen keine Beine. Die Eier messen nur 0,45 mm im Durchmesser. Männchen sind erkennbar an den fehlenden Eiersäcken. Hermaphroditen und Weibchen sehen nahezu identisch aus, die Hermaphroditen haben neben den Eierstöcken jedoch auch Hoden. Lepidurus apus gilt als „lebendes Fossil“, da er morphologisch beinahe identisch zu fossilen Rückenschalern ist, die vor etwa 300 Millionen Jahren lebten. Dies ist vermutlich auf die hochkonservierte Morphologie der Rückenschaler oder Homoplasie zurückzuführen, ob die Art sich auch genetisch nur wenig entwickelt hat, ist fragwürdig.
Verbreitung
Lepidurus apus ist in verschiedenen Teilen der Erde verbreitet und hat eines der größten Verbreitungsgebiete aller Arten der Familie Triopsidae. Der größte Teil des Verbreitungsgebietes reicht von Westeuropa bis Zentralasien. Hier kommt die Art von den Pyrenäen und Westfrankreich im Westen bis ins russische Zentralasien im Osten vor, wobei sie auf den Britischen Inseln fehlt. Die nördlichsten Vorkommen liegen dabei im südlichen Schweden, in Estland und in Russland bis etwa 60° nördlicher Breite. Im Süden ist die Art bis in das französische und italienische Mittelmeergebiet verbreitet, fehlt aber in Südosteuropa. Südlich davon finden sich weitere Vorkommen vom nördlichen bis südwestlichen Israel[1] und im Iran südwestlich des Kaspischen Meeres[2]. Darüber hinaus ist die Art im südlichen bis südöstlichen Australien inklusive Tasmanien und auf Neuseeland mit beiden Hauptinseln vertreten. Auch in Nordkalifornien[3], Utah[1] und Nordafrika[2] gibt es möglicherweise Vorkommen. Trotz des großen Verbreitungsgebietes insgesamt kommt die Art bei weitem nicht flächendeckend vor. In Dänemark beispielsweise ist sie nur in einem recht kleinen Gebiet im Osten zu finden.[4] Ähnliche Muster finden sich auch in anderen Ländern. Die meisten Nachweise der Art stammen aus Frankreich, Deutschland, Österreich und Australien.[5]
Lebensraum

Lepidurus apus ist eine typische Art temporärer kleiner Süßgewässer, die meist nur 10 bis 100 cm tief sind. Dazu zählen beispielsweise Schmelzwassertümpel, Regenpfützen, durch Überflutungen entstandene Stillgewässer wie Flutmulden, Überschwemmungstümpel und Auengewässer oder auch binnendeichs gelegene Druckwassertümpel (Qualmwasser) in den Flussauen oder Nassreisfelder wie in Norditalien. In trockeneren Gebieten trocknen solche Gewässer im Sommerhalbjahr meist aus, während Regenpfützen generell nur selten langlebig sind. In einigen Gebieten sind die Gewässer aber auch ganzjährig vorhanden. Für die Bildung von niederschlagsbedingten Kleingewässern sind lehmige Böden von Vorteil, weshalb Gebiete mit solchen Böden als Lebensräume bevorzugt werden. Außerdem bevorzugt werden sonnige Gewässer. Seltener lebt die Art auch in dauerhaften Gewässern, wie Stillgewässern in Marsch- und Sumpfländern oder staunassen Senken und Gräben. Lepidurus apus viridis lebt in Neuseeland beispielsweise gerne in solchen dauerhaften Gewässern. Der bevorzugte pH-Wert der Art liegt zwischen 6 und 8, außerdem ist sie recht tolerant gegenüber hohen Konzentrationen von Nitrat und Phosphat. In Deutschland findet sich die Art oft mit anderen Kiemenfußkrebsen vergesellschaftet wie Triops cancriformis, Eubranchipus grubii oder Tanymastix stagnalis.
Populationen in Israel
In Israel bewohnt die Art große Regenpfützen, die durch die Entwicklung von Landwirtschaft und Urbanisierung jedoch zunehmend gefährdeter werden. Diese Regenpfützen oder -tümpel treten vom späten Herbst bis zum Frühjahr auf, trocknen im Sommer jedoch aus und halten sich nur wenige Wochen bis zu acht Monaten. In diesen Gewässern kommt die Art in Ausnahmefällen auch gemeinsam mit der in Israel selteneren Art Triops cancriformis vor. Die optimalen Bruttemperaturen für die Eier liegen in den israelischen Populationen etwa zwischen 16 und 20° C, obwohl auch zwischen 10 und 24° C noch Nauplien schlüpfen. Im Gegensatz dazu bevorzugt T. cancriformis hier Temperaturen zwischen 24 und 32° C, wobei generell zwischen 16 und 35° C Nauplien schlüpfen.[1]
Populationen im Iran
Im Iran bewohnt die Art Schmelzwassertümpel in montanen Steppen und Kulturland auf lehmigen Böden über Vulkanstein. Hier sind die Winter sehr kalt und von starken Schneefällen geprägt, weshalb es ab dem Frühling zu einer starken Bildung von Schmelzwassertümpeln kommt, die sich bis zum Sommer halten. Hier leben außerdem zahlreiche Algengattungen, der Kiemenfußkrebs Branchinecta orientalis, verschiedene andere kleine Krebstiere sowie Brandgänse und Rostgänse. In der Population wurden ausschließlich weibliche Individuen nachgewiesen.[2]
Populationen in den USA
In Utah findet ein Schlupf der Eier bei Temperaturen über 10° C statt.[1]
Lebensweise
_underside_..._(42761035090).jpg.webp)
Lebenszyklus
Lepidurus apus legt Dauereier (Zysten) am Bodengrund der Gewässer oder an Pflanzenteilen ab. Diese überstehen auch längere, sogar mehrjährige, Trocken-, Frost- oder Hitzeperioden. In Rekordfällen konnten Eier auch nach 28 Jahren Trockenheit zum Schlupf gebracht werden. Auch wurde gezeigt, dass die Zysten bei Sauerstoffmangel Hämoglobin produzieren können. Die Gelege zerfallen natürlicherweise nach einiger Zeit, wodurch die Eier nicht mehr in Paketen, sondern vereinzelt vorliegen. Unter lebensbedrohlichen Situationen kann es auch zu einer stressbedingten Eiablage kommen. Dabei öffnen sich – vermutlich durch eine Erhöhung des Turgors – die Eitaschen, wodurch die Zysten freigesetzt und durch die Wasserströmung zwischen den Blattbeinen verteilt werden.[6]
Bei geeigneten Bedingungen, wie Temperaturen über dem Nullpunkt, stärkerem Lichteinfall[1] und dem Umgebensein von Wasser – in Mitteleuropa im Frühjahr – schlüpfen aus den Eiern die Naupliuslarven. Diese entwickeln sich bei den noch kühlen Temperaturen zu den geschlechtsreifen Individuen, bei deren Weibchen oder Hermaphroditen Eisäcke entstehen und die schließlich die Eier legen. Die Entwicklung erfolgt wesentlich langsamer als bei der verwandten Gattung Triops, da L. apus an kühlere Temperaturen angepasst ist und deshalb nicht in akut vor Austrocknung gefährdeten Gewässern vorkommt, in denen eine noch schnellere Entwicklung vonnöten wäre. Dennoch findet die Entwicklung relativ schnell innerhalb weniger Wochen statt. Dabei können innerhalb von zwei Wochen geschlechtsreife Individuen entstehen, manchmal dauert es aber auch vier Wochen. Durch diese temperaturbedingte zeitliche Trennung kommt es in Mitteleuropa auch nicht zur Konkurrenz zwischen Triops cancriformis und Lepidurus apus, selbst wenn diese in denselben Gewässern leben.
In Mitteleuropa ist Lepidurus apus meist von März bis Juni zu finden[4], schlüpft aber manchmal auch schon im Februar. Der Schlupf kann sich aber auch bis in den Mai verzögern.
Von Lepidurus apus gibt es sowohl eingeschlechtliche Populationen, die nur aus Weibchen bestehen, als auch zweigeschlechtliche Populationen mit Männchen, die beispielsweise in manchen italienischen Populationen jedoch keine Funktion erfüllen. Zudem gibt es hermaphroditische Populationen, beispielsweise bei der Unterart L. apus viridis. Meistens findet die Fortpflanzung parthenogenetisch statt.
Ausbreitung
Eine Verbreitung der Art erfolgt meist passiv, in dem die Eier von Wind, Wasser, Wasservögeln oder anderen abiotischen und biotischen Faktoren transportiert werden. So können sich durch die Verbreitung durch Vögel neue Populationen auch weit entfernt der ursprünglichen Gewässer bilden. Auch eine Verbreitung durch den Menschen ist so möglich. Wichtig für ein Überleben der Art sind jedoch Gewässer, die saisonal immer wieder überflutet werden oder nicht austrocknen, damit die Dauereier in einem der folgenden Frühjahre erneut günstige Bedingungen für den Schlupf vorfinden. Aus diesem Grund stellen Landschaftsveränderungen, beispielsweise die Trockenlegung von Landschaften durch landwirtschaftliche Intensivierung oder die Bebauung von Flächen, eine ernstzunehmende Bedrohung für die Art dar.
Trophische Interaktionen
Lepidurus apus ernährt sich von im Wasser umherschwebendem Detritus, pflanzlichem Material, Algen, Pilzen, Myxozoen, Bakterien und kleinen tierischen Organismen wie Kiemenfußkrebsen der Gattung Branchinecta (z. B. Branchinecta paludosa) oder Daphnien („Wasserflöhen“). Zur Nahrungsaufnahme schwimmen die Tiere meist über den Bodengrund, wobei dieser häufig aufgewirbelt wird. Als Feinde der Art sind Wasservögel bekannt. An manchen Orten stellen die Massenauftreten von Lepidurus apus eine wichtige Nahrungsquelle für Zugvögel dar.[2] Neben großen Wasservögeln (Enten, Gänsen) fressen auch kleinere Vögel der Uferbereiche (z. B. verschiedene Schnepfenvögel) Lepidurus apus, außerdem in manchen Gewässern auch Fische. Nosema lepiduri, ein parasitischer Pilz der Microsporidia, ist dafür bekannt, die Art zu parasitieren. Befallene Tiere weisen eine milchigweiße Färbung am Carapax und den Beinen auf und sterben manchmal. Die Infektion erfolgt über Sporen. Der Parasit lebt vor allem in flachen Gewässern mit weniger als 15 cm Tiefe.
Gefährdung
In vielen Ländern ist die Art durch Lebensraumverluste stark zurückgegangen. In Deutschland gilt sie als stark gefährdet (RL 2, endangered ![]() ). Der langfristige Bestandstrend zeigt einen starken Rückgang. Deutschland obliegt eine allgemeine Verantwortlichkeit der Art, da ein großer Teil des europäischen Verbreitungsgebietes der Art in Deutschland liegt.[7] In Österreich gilt die Art als potentiell gefährdet (RL 4/VW, near threatened
). Der langfristige Bestandstrend zeigt einen starken Rückgang. Deutschland obliegt eine allgemeine Verantwortlichkeit der Art, da ein großer Teil des europäischen Verbreitungsgebietes der Art in Deutschland liegt.[7] In Österreich gilt die Art als potentiell gefährdet (RL 4/VW, near threatened ![]() ).[8] In manchen Bundesländern kann die Gefährdungskategorie abweichen, so gilt die Art in Sachsen-Anhalt oder Niederösterreich beispielsweise nur als gefährdet (RL 3), in Thüringen jedoch als vom Aussterben bedroht (RL 1), während sie in Bayern der Gesamtsituation Deutschlands entspricht und hier ebenfalls stark gefährdet ist. In Rheinland-Pfalz findet sich die Art nur noch an drei Fundorten, von denen zwei nahe bei Mainz liegen und einer bei Neuburg am Rhein. Auch in Brandenburg gibt es nur vereinzelte Vorkommen, beispielsweise in den Uckermärkischen Seen. In Niedersachsen kommt die früher weiter verbreitete Art nur noch im Leinetal vor. In der ehemaligen DDR wurde die Art vor allem in den zentralen bis südlichen Gebieten gefunden.[9] Vorkommen der Art können häufig nicht jedes Jahr erneut erbracht werden. In vielen Fällen vergehen mehrere Jahre, bis die Art erneut an einem Ort entdeckt wird. Diese Intervalle können sogar bis zu über 4 Jahre betragen, im Schnitt 2,8 Jahre.[6]
).[8] In manchen Bundesländern kann die Gefährdungskategorie abweichen, so gilt die Art in Sachsen-Anhalt oder Niederösterreich beispielsweise nur als gefährdet (RL 3), in Thüringen jedoch als vom Aussterben bedroht (RL 1), während sie in Bayern der Gesamtsituation Deutschlands entspricht und hier ebenfalls stark gefährdet ist. In Rheinland-Pfalz findet sich die Art nur noch an drei Fundorten, von denen zwei nahe bei Mainz liegen und einer bei Neuburg am Rhein. Auch in Brandenburg gibt es nur vereinzelte Vorkommen, beispielsweise in den Uckermärkischen Seen. In Niedersachsen kommt die früher weiter verbreitete Art nur noch im Leinetal vor. In der ehemaligen DDR wurde die Art vor allem in den zentralen bis südlichen Gebieten gefunden.[9] Vorkommen der Art können häufig nicht jedes Jahr erneut erbracht werden. In vielen Fällen vergehen mehrere Jahre, bis die Art erneut an einem Ort entdeckt wird. Diese Intervalle können sogar bis zu über 4 Jahre betragen, im Schnitt 2,8 Jahre.[6]
Der Lebensraumverlust der Art hat viele Ursachen, beispielsweise die Absenkung des Grundwasserspiegels, Verfüllungen und Drainierungen von Senken und Feuchtwiesen, Vertiefungen temporärer Senken in dauerhaft wasserführende Gewässer oder den Ausbau von Flüssen und die Umwandlung von Grünländern in Ackerland, besonders in den Flussauen. Diese Veränderungen entstehen oft im Zuge der Intensivierung der Landwirtschaft oder die Erschließung von Flächen für die Bebauung. Wichtig für den Schutz der Art wäre die Erhaltung ihrer Auenlebensräume, z. B. durch die Renaturierung der Verläufe mittlerer und kleiner Flüsse, aber auch eine extensive, düngungs- und biozidfreie landwirtschaftliche Nutzung von Ackerflächen am Rande von Auenwaldbiotopen.[6]
Zucht
Die Art wird, ähnlich wie Triops cancriformis auch in Aquarien gezüchtet. Lepidurus apus gilt dabei aber als anspruchsvoller und benötigt Kaltwasser unter 15° C.[10]
Taxonomie
Die Art wurde 1758 von Carl von Linné unter dem Namen Monoculus apus erstbeschrieben. Weitere Synonyme der Art lauten Apus productus Bosc, 1801, Lepidurus angasi Baird, 1866, Lepidurus macrourus Lilljeborg, 1877, Lepidurus compressus Thompson, 1879, Lepidurus kirki Thompson, 1879, Lepidurus viridulus Tate, 1879, Apus extensus Braem, 1893, Lepidurus hatcheri Ortmann, 1911 und Lepidurus barcaeus Ghigi, 1921.
Unterarten
Es wurden mehrere, teilweise geographisch getrennte, Unterarten beschrieben. Diese sind:[3]
- Lepidurus apus apus – die weit verbreitete Nominatform, Europa, Asien, Nordamerika ohne Kalifornien[11]
- Lepidurus apus lubbocki Brauer, 1873 – verbreitet u. a. in Israel und Italien, eventuell auch weiter in Nordafrika oder Westasien[2][1][12][11]
- Lepidurus apus viridis Baird, 1850 – verbreitet in Australien und Neuseeland[2]
Lepidurus apus patagonicus Berg, 1900 wird für die Provinz Chubut in Patagonien angegeben, aufgrund der sehr wenigen Erwähnungen in Publikationen ist diese Unterart sowie das Vorkommen jedoch zweifelhaft.[11] Die ehemalige Unterart Lepidurus apus packardi Simon, 1886 – verbreitet in Kalifornien[11] – wird mittlerweile als eigenständige Art Lepidurus packardi angesehen[13], womit eine Verbreitung von Lepidurus apus in Kalifornien überholt wäre. Die Unterart Lepidurus apus lubbocki wird manchmal als eigene Art, Lepidurus lubbocki, angesehen.
Weblinks
- Laubfrosch Hannover. Frosch, Wasser & Co. Abgerufen am 28. April 2021.
Einzelnachweise
- Z. Kuller & A. Gasith (1996) Comparison of the hatching process of the tadpole shrimps Triops cancriformis and Lepidurus apus lubbocki (Notostraca) and its relation to their distribution in rain-pools in Israel. Hydrobiologia 335:147–157. doi:10.1007/bf00015276.
- Behroz Atashbar, Naser Agh, Lynda Beladjal & Johan Mertens (2013) On the occurence of Lepidurus apus (Linnaeus, 1758) (Crustacea, Notostraca) from Iran. Journal of Biological Research-Thessaloniki 19:75–79. Link
- Lepidurus apus (Linnaeus, 1758) in GBIF Secretariat (2021). GBIF Backbone Taxonomy. Checklist dataset abgerufen via GBIF.org am 28. April 2021.
- Jakob Damgaard & Jørgen Olesen (1998) Distribution, phenology and status for the larger Branchiopoda (Crustacea:Anostraca, Notostraca, Spinicaudata and Laevicaudata) in Denmark. Hydrobiologia 377:9–13. doi:10.1023/A:1003256906580.
- Lepidurus apus in der Encyclopedia of Life, abgerufen am 28. April 2021.
- Wolf-Rüdiger Grosse und Mario Engelmann (2002) Stetigkeit und Gefährdung von Lepidurus apus (L.) und Eubranchipus (Siphonophanes) grubei DYBOWSKI (Crustacea: Notostraca, Anostraca). Hercynia N.F. 35:123–136. Link
- Simon, L. (2016): Rote Liste und Gesamtartenliste der Blattfußkrebse (Branchiopoda: Anostraca, Conchostraca, Notostraca) Deutschlands. – In: Gruttke, H., Balzer, S., Binot-Hafke, M., Haupt, H., Hofbauer, N., Ludwig, G., Matzke-Hajek, G. & Ries, M. (Bearb.): Rote Liste der gefährdeten Tiere, Pflanzen und Pilze Deutschlands. Band 4: Wirbellose Tiere (Teil 2). – Bonn (Bundesamt für Naturschutz). – Naturschutz und Biologische Vielfalt 70 (4): 367–378.
- Eder, E., Hödl, W. (2002): Large freshwater branchiopods in Austria: diversity, threats and conservational status. In: Escobar-Briones, E., Alvarez, F. (eds.): Modern approaches to the study of Crustacea. Dordrecht, Kluwer Academic Publishers: 281–289.
- Volker Neumann & Dietrich Heidecke (1989) Die Verbreitung von L epidurus apus L. und Triops cancriformis Bosc in der DDR. Hercynia N.F. 26:387–399. Link
- Lepidurus apus auf koenigstigers-urzeitkrebse.de, abgerufen am 28. April 2021.
- Alan R. Longhurst (1955) A Review Of The Notostraca Bulletin of the British Museum (Natural History) Zoology Vol. 3 No. 1. Link
- Franca Scanabissi & Corrado Mondini (2002) A survey of the reproductive biology in Italian branchiopods. Part A. The female gonad of Limnadia lenticularis (Linnaeus, 1761) (Spinicaudata) and Lepidurus apus lubbocki Brauer, 1873 (Notostraca). Hydrobiologia 486:263–272. doi:10.1023/a:1021371306687.
- D. Christopher Rogers (2001) Revision Of The Nearctic Lepidurus (Notostraca). Journal Of Crustacean Biology 21(4):991–1006. Link