Inosin
Inosin ist ein seltenes Nukleosid der RNA. Es besteht aus der β-D-Ribofuranose (Zucker) und dem Hypoxanthin, einer Base, die ein Purin als Grundgerüst hat, welches als Zwischenprodukt des Purinstoffwechsels entsteht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
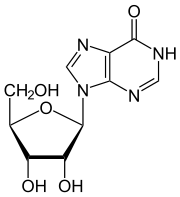 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Inosin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H12N4O5 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Immunstimulans | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 268,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (2,1 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
In der tRNA paart Inosin im Anticodon als Nukleotid in der Wobble-Position mit Cytidin, Uridin und Adenosin. Diese Modifikation wurde in manchen tRNAs von Eukaryoten, Prokaryoten und Chloroplasten gefunden.[4] Beim sogenannten RNA-Editing wird Adenosin durch das Enzym ADAR (Adenosine Deaminase acting on RNA) in Inosin umgewandelt. In Backhefe wird die Umwandlung von Adenosin in Inosin in der tRNAAla an Position 34 durch die tRNA-spezifische Deaminase Tad2p/3p, ein Heterodimer, katalysiert; an Position 37 geschieht dies durch Tad1p.
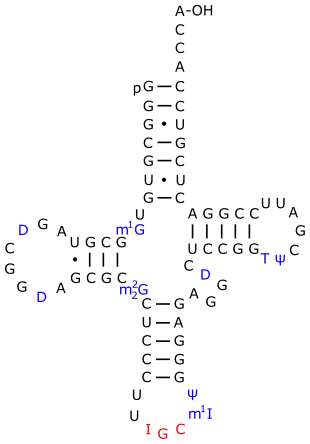 Eine tRNAAla aus S. cerevisiae.
Eine tRNAAla aus S. cerevisiae.
Inosin ist hier an Position 34 mit I gekennzeichnet. Methyliertes Inosin (m1I) ist an Position 37 hervorgehoben.
Inosin wird bei der Konstruktion degenerierter Primer für die Polymerase-Kettenreaktion verwendet. Es dient hier als „neutrale“ Base, die Paarungen mit allen vier Basen eingehen kann. Allerdings ist die Paarung in allen vier Fällen energetisch ein wenig ungünstig und nicht für alle vier Basenpaarungen gleich. Die günstigste Paarung wird mit Cytosin eingegangen, gefolgt von Adenin. Die Paarung mit Guanin und Thymin sind beide etwa energetisch gleich und am ungünstigsten.[5]
Verwendung
Inosin wird für die Anwendung bei Patienten mit Morbus Parkinson getestet. Das Zwischenprodukt im Purinstoffwechsel wird im Körper teilweise zu Harnsäure umgewandelt. Ein hoher Harnsäurespiegel konnte mit einer langsameren Progression der Parkinson-Krankheit in Zusammenhang gebracht werden.[6][7]
Eine Phase-II-Studie konnte nun zeigen, dass es unter der Behandlung zu keinen schweren Nebenwirkungen kommt,[8] auch wenn hohe Harnsäurespiegel theoretisch die Gefahr von Gicht, Nierensteinen und einem erhöhten kardiovaskulären Risiko bergen. Die Studie zeigte für alle drei Erkrankungen kein erhöhtes Risiko während der Inosin-Behandlung.
Inosin gilt als möglicherweise wichtige Komponente der chemischen Evolution. In Versuchen wies Inosin vernünftige Raten und Genauigkeit bei RNA-Kopierreaktionen auf (RNA-Welt-Hypothese). Inosin könnte in der frühen Phase der Entstehung des Lebens als Ersatz für Guanosin gedient haben.[9]
Siehe auch
Weblinks
- Eintrag zu Inosine in der Human Metabolome Database (HMDB), abgerufen am 24. September 2013.
- Modification Summary von Inosine in der Modomics-Datenbank, abgerufen am 14. Januar 2014.
Einzelnachweise
- Eintrag zu INOSINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- Datenblatt Inosine, 98+% bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- Datenblatt Inosin bei Acros, abgerufen am 17. Februar 2013.
- Gerber, AP. und Keller, W. (1999): An adenosine deaminase that generates inosine at the wobble position of tRNAs. In: Science 286(5442); 1146–1149; PMID 10550050; doi:10.1126/science.286.5442.1146
- S. C. Case-Green, E. M. Southern: Studies on the base pairing properties of deoxyinosine by solid phase hybridisation to oligonucleotides, Nucleic Acids Res., 1994, 22 (2), S. 131–136 (PMC 307762 (freier Volltext); PMID 8121796).
- C. C. Sun et al. (2012): Association of serum uric acid levels with the progression of Parkinson's disease in Chinese patients., Chinese medical journal. Band 125, Nummer 4, S. 583–587, PMID 22490478.
- Tua Annanmaki et al. (2011): Uric acid and cognition in Parkinson’s disease: A follow-up study., Parkinsonism & Related Disorders. 17, S. 333–337, doi:10.1016/j.parkreldis.2011.01.013.
- M. A. Schwarzschild et al. (2014): Inosine to Increase Serum and Cerebrospinal Fluid Urate in Parkinson Disease: A Randomized Clinical Trial. In: JAMA neurology 71(2); 141–150; PMID 24366103; doi:10.1001/jamaneurol.2013.5528
- Seohyun Chris Kim, Derek K. O’Flaherty, Lijun Zhou, Victor S. Lelyveld, Jack W. Szostak: Inosine, but none of the 8-oxo-purines, is a plausible component of a primordial version of RNA. In: Proceedings of the National Academy of Sciences. 115, 2018, S. 13318, doi:10.1073/pnas.1814367115.