Phalloidin
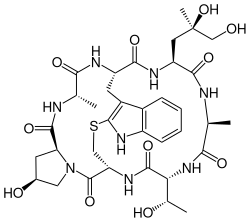
Phalloidin ist der Hauptvertreter der Phallotoxine und eines der Toxine des Grünen Knollenblätterpilzes (Amanita phalloides). Es ist ein Cyclopeptid aus sieben durch Peptidbindungen miteinander verketteten Aminosäuren, von denen zwei zusätzlich über eine Sulfid-Brücke zwischen ihren Seitenketten als Tryptathionin verbunden werden, sodass ein bicyclisches Heptapeptid entsteht. Diese Strukturmerkmale kennzeichnen alle Phallotoxine und liegen so ähnlich nur in den aus acht Aminosäuren aufgebauten Amatoxinen vor, wo die Trp-Cys-Querbrücke als Sulfoxid ausgebildet ist.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phalloidin | |||||||||||||||
| Summenformel | C35H48N8O11S | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 788,88 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Phalloidin wurde erstmals 1937 von Feodor Lynen und Ulrich Wieland kristallisiert dargestellt, seine Struktur später von Theodor Wieland ermittelt.[4][5]
Vorkommen
In verschiedenen Arten der Knollenblätterpilze wurde Phalloidin neben weiteren Phallotoxinen sowie den Amatoxinen gefunden. Der Kegelhütiger Knollenblätterpilz (Amanita virosa) enthält außerdem Virotoxine, den Phallotoxinen ähnliche monocyclische Heptapeptide, bei denen eine innere Querbrücke fehlt. Der Gelbe Knollenblätterpilz (Amanita citrina) dagegen, der auch mit weißer Variante auftritt, enthält lediglich Bufotenin.[6]
Eigenschaften
Bei oraler Aufnahme ist Phalloidin unwirksam, da es vom gesunden Darm nicht aufgenommen wird. Doch injiziert verändert es infolge seiner irreversiblen Bindung an polymerisiertes Aktin insbesondere die Zellen der Leber und kann innerhalb weniger Stunden tödlich wirken; die LD50 (Maus i.p.) beträgt 2 mg/kg.[7]
Die hohe Affinität zu filamentösem (F-)Aktin kann in spezifischen molekularbiologischen Färbetechniken genutzt werden, um Anteile des Cytoskeletts sichtbar zu machen. Dabei wird Phalloidin eingesetzt, an das ein fluoreszierender Farbstoff gebunden ist. Dessen abgestrahltes Licht wird bei der Fluoreszenzmikroskopie mit hoher Auflösung aufgefangen und man erhält damit Informationen über die Verteilung von F-Aktin in einer Zelle.
Einzelnachweise
- Eintrag zu Phalloidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 444 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peptides: Advances in Research and Application: 2011 Edition. ScholarlyEditions, 2012, ISBN 978-1-4649-2309-8, S. 4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Theodor Wieland: Moderne Naturstoffchemie am Beispiel des Pilzgiftstoffes Phalloidin Vorgetragen in der Sitzung vom 25. April 1981. Springer-Verlag, 2013, ISBN 978-3-642-46451-5, S. 22 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernd Gutte: Peptides Synthesis, Structures, and Applications. Academic Press, 1995, ISBN 978-0-08-053859-4, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Benk, A. Th. Czaja, W. Bötticher, H. Drews, J. Gutschmidt, K. Herrmann, A. S. Kovacs, F. Martens, H. Mohler, P. Nehring, F. Reiff, H. Sulser: Obst, Gemüse, Kartoffeln, Pilze 2. Teil. Springer-Verlag, 2013, ISBN 978-3-642-87680-6, S. 521 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Phalloidin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 3. Mai 2017.
