Phallotoxin
Phallotoxine sind neben den Amatoxinen weitere giftige Inhaltsstoffe bestimmter Arten der Wulstlinge (Amanita), so Grüner Knollenblätterpilz (A. phalloides) sowie die weißen Knollenblätterpilze Frühlings- (A. verna) als auch Kegelhütiger Knollenblätterpilz (A. virosa).

Bei einer Knollenblätterpilz-Vergiftung spielen die Phallotoxine, die als bizyklische Heptapeptide aus sieben ringförmig verbundenen Aminosäuren aufgebaut sind, eine geringere Rolle als die verwandten Oktapeptide der Amatoxine, da sie nicht wie diese über den Darm aufgenommen werden. Gelangen sie dennoch in die Blutbahn, ist ihre Wirkung rascher und ebenfalls hochtoxisch.
Die Phallotoxine gehören zu den Zytoskelett-Inhibitoren und blockieren dessen Umbau. Ihre Eigenschaft als Stabilisatoren für Aktinfilamente macht man sich in der Molekularbiologie zunutze, um Elemente des Zellskeletts besser darstellen zu können. Phallotoxine sind zumeist amorphe, wasserlösliche Feststoffe. Bis heute sind sieben natürlich vorkommende bekannt, die alle ein gleiches Grundgerüst aufweisen: neben Phalloidin auch Phalloin, Phallisin, Phallacin, Phallicidin, Phallisacin und Prophalloin.
Geschichte
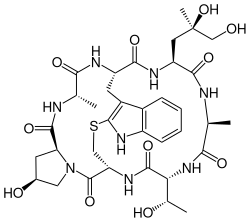
Als eines der Toxine des Grünen Knollenblätterpilzes (Amanita phalloides) wurde der Hauptvertreter der Phallotoxine, das Phalloidin, erstmals 1936 von Feodor Lynen und Ulrich Wieland kristallin dargestellt, im Chemischen Institut der Uni München unter Leitung Heinrich Wielands.[1] Die Struktur dieses Peptids untersuchte Theodor Wieland ab den 1950er Jahren näher. Es war das erste entdeckte cyclische Peptid.[2] Die helikale Konformation seines besonderen Strukturelements, einer Thioetherbrücke über ein S-Atom, konnte erst spät geklärt werden; dieses macht es zu einem bicyclischen Peptid mit außergewöhnlicher Rigidität und hoher Stabilität.
Merkmale
Alle natürlich vorkommenden Phallotoxine sind Cyclopeptide aus sieben Aminosäuren, von denen zwei als Tryptathionin über eine zusätzliche Sulfid-Querbrücke verbunden werden, sodass ein bicyclisches Heptapeptid vorliegt. Ähnliche Strukturmerkmale weisen die aus acht Aminosäuren aufgebauten Amatoxine auf, wo die Trp-Cys-Querbrücke als Sulfoxid ausgebildet ist.
Im Unterschied zu diesen Oktapeptiden sind die Phallotoxine bei oraler Aufnahme nahezu unwirksam, da sie vom gesunden Darm nicht aufgenommen werden. Gelangen sie jedoch – durch Schleimhautwunden oder injiziert – in die Blutbahn, entfalten sie rasch ihre Toxizität, insbesondere in Zellen der Leber, und können innerhalb weniger Stunden tödlich wirken. Die letale Dosis LD50 (Maus i.p.) beträgt für den Hauptvertreter Phalloidin 2 bis 3 mg/kg. Allen Phallotoxinen ist das gleiche Grundgerüst gemeinsam, die einzelnen Vertreter unterscheiden sich voneinander in den Resten von Seitenketten.
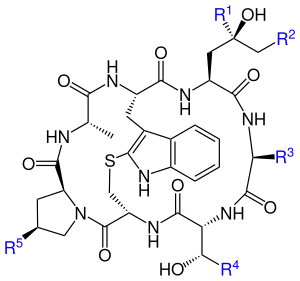
Vertreter
| Name | R1 | R2 | R3 | R4 | R5 |
|---|---|---|---|---|---|
| Phallacin | CH3 | H | CH(CH3)2 | COOH | OH |
| Phallacidin | CH3 | OH | CH(CH3)2 | COOH | OH |
| Phallisacin | CH2OH | OH | CH(CH3)2 | COOH | OH |
| Phallisin | CH2OH | OH | CH3 | CH3 | OH |
| Phalloidin | CH3 | OH | CH3 | CH3 | OH |
| Phalloin | CH3 | H | CH3 | CH3 | OH |
| Prophalloin | CH3 | H | CH3 | CH3 | H |
 Phallacin
Phallacin Phallacidin
Phallacidin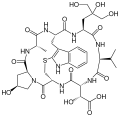 Phallisacin
Phallisacin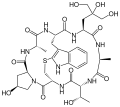 Phallisin
Phallisin
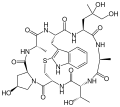 Phalloin
Phalloin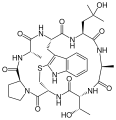 Prophalloin
Prophalloin
Vorkommen
In verschiedenen Arten der Knollenblätterpilze wurde Phalloidin neben weiteren Phallotoxinen sowie den Amatoxinen gefunden. Der Kegelhütige Knollenblätterpilz (Amanita virosa) enthält außerdem Virotoxine, den Phallotoxinen ähnliche monozyklische Heptapeptide, bei denen eine innere Querbrücke fehlt. Der Gelbe Knollenblätterpilz (Amanita citrina) dagegen, der auch mit weißer Variante auftritt, enthält lediglich Bufotenin.
Wirkungsweise
Das wesentliche Wirkprinzip ist eine Hemmung des (für Zellbewegungen nötigen) Umbaus des Zytoskeletts. Phallotoxine binden irreversibel an polymerisiertes Aktin – das F-Aktin, aus dem Aktin-Filamente bestehen – und behindern damit den Ab- und Umbau dieser filamentösen Strukturen.
Die hohe Affinität zum F-Aktin der Mikrofilamente wird in spezifischen molekularbiologischen Färbetechniken genutzt, um Anteile des Cytoskeletts sichtbar zu machen.
Siehe auch
Im Unterschied zu den Phallotoxinen, welche die Depolymerisation von F-Aktin behindern, wirken die Latrunculine – besondere Toxine mariner Schwämme und Schnecken – als Zytoskelett-Inhibitoren, indem sie die Polymerisation von G-Aktin zu Mikrofilamenten stören.
Literatur
- Eintrag zu Phallotoxine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- Theodor Wieland: Amatoxine, Phallotoxine – die Gifte des Knollenblätterpilzes, Chemie in unserer Zeit, 13. Jahrg. 1979, Nr. 2, S. 56–63, ISSN 0009-2851
Einzelnachweise
- Theodor Wieland: Moderne Naturstoffchemie am Beispiel des Pilzgiftstoffes Phalloidin Vorgetragen in der Sitzung vom 25. April 1981. Springer-Verlag, 2013, ISBN 978-3-642-46451-5, S. 22 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernd Gutte: Peptides Synthesis, Structures, and Applications. Academic Press, 1995, ISBN 978-0-08-053859-4, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).