Dermorphin
Dermorphin ist ein starkes Opioidpeptid, das von der Haut eines südamerikanischen Frosches der Gattung Phyllomedusa[3] gebildet wird und 1981 entdeckt wurde.[4] Sein Name leitet sich ab aus altgriech. δέρμα derma ‚Haut‘ und dem Namen des Gottes der Träume, Morpheus (Μορφεύς, abgeleitet aus μορφή morphe ‚Gestalt, Form‘).
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
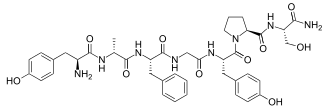 | ||||||||||
| Allgemeines | ||||||||||
| Name | Dermorphin | |||||||||
| Andere Namen |
Tyrosyl-alanyl-phenylalanyl-glycyl-tyrosyl-prolyl-serinamid | |||||||||
| Summenformel | C40H50N8O10 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 802,89 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Allgemeines
Dermorphin ist ein natürliches Opioid, also eine Verbindung, die ähnlich wie z. B. Morphin und andere Opiumalkaloide auf das Nervensystem wirkt. Es bindet sich wesentlich wirksamer als Morphin an Opioidrezeptoren[5][6] und ist etwa 30- bis 40-mal wirksamer als dieses. Dermorphin als Arzneistoff verspricht eine geringere Toleranzentwicklung und ein niedrigeres Suchtpotential als gängige Opioide.[7]
Es wirkt auf den Blutkreislauf, den Verdauungstrakt und das Nervensystem, jedoch kann nur ein kleiner Bruchteil des Stoffs die Blut-Hirn-Schranke überwinden. Die erste bekannte therapeutische Verwendung wird beim Matsés-Stamm im oberen Amazonasbecken beschrieben: Sie nutzen die getrocknete Haut des Phyllomedusa-Frosches, um Wunden zu behandeln. Mögliche Effekte dieser Behandlung sind abgeschwächtes Schmerzempfinden und vorübergehende Euphorie. Dermorphin und seine Derivate zeigen aufgrund der hohen Wirksamkeiten große Potentiale als Analgetika, jedoch wurde Dermorphin selbst in keiner klinischen Studie getestet. Analoga, die leichter die Blut-Hirn-Schranke überwinden und länger wirken, werden gegenwärtig studiert.[8][9]

Chemische Struktur
Dermorphin ist ein Peptid, das sich aus sieben Aminosäuren zusammensetzt. Die Aminosäuresequenz ist H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2.
Dermorphin hat strukturelle Ähnlichkeit mit Endorphinen, einer Familie von Neuropeptiden der Wirbeltiere, ist jedoch um eine Größenordnung wirksamer.[10] Was die hohe Wirksamkeit des Moleküls bedingt, ist aktuell (Stand August 2015) unbekannt.
Biosynthese
Der Frosch produziert zunächst ein Vorläuferpeptid des Dermorphins mit der Aminosäure L-Alanin, dem in der Natur meist vorkommenden L-Enantiomer des Alanins. Nach der Synthese wird dieses L-Alanin mit Hilfe eines Enzyms, einer Epimerase, in die D-Form umgewandelt.[11]
Ähnlich wie andere Peptide, die D-Aminosäuren enthalten, wurde Dermorphin bisher noch in keinem Säugetier gefunden (Stand August 2015).[12] Über die biologische Funktion des Dermorphins für den Frosch ist bisher (Stand August 2015) nichts bekannt.
Illegale Verwendung im Pferdesport
Dermorphin wurde in Pferderennen als leistungssteigernde Droge missbraucht, weil die schmerzunterdrückende Wirkung die Pferde zu höherer Leistung bringen konnte.[13][14]
Einzelnachweise
- Datenblatt Dermorphin bei AlfaAesar, abgerufen am 16. August 2015 (PDF) (JavaScript erforderlich).
- Datenblatt Dermorphin trifluoroacetate salt, ≥98 % (HPLC) bei Sigma-Aldrich, abgerufen am 16. August 2015 (PDF).
- P. Melchiorri, L. Negri: The dermorphin peptide family. In: General pharmacology. Band 27, Nummer 7, Oktober 1996, S. 1099–1107, PMID 8981054 (Review).
- P. C. Montecucchi, R. de Castiglione, V. Erspamer: Identification of dermorphin and Hyp6-dermorphin in skin extracts of the Brazilian frog Phyllomedusa rhodei. In: International journal of peptide and protein research. Band 17, Nummer 3, März 1981, S. 316–321, PMID 7287302.
- M. Amiche, A. Delfour, P. Nicolas: Opioid peptides from frog skin. In: EXS. Band 85, 1998, S. 57–71, PMID 9949868 (Review).
- V. Erspamer, P. Melchiorri, G. Falconieri-Erspamer, L. Negri, R. Corsi, C. Severini, D. Barra, M. Simmaco, G. Kreil: Deltorphins: a family of naturally occurring peptides with high affinity and selectivity for delta opioid binding sites. In: Proceedings of the National Academy of Sciences. Band 86, Nummer 13, Juli 1989, S. 5188–5192, PMID 2544892, PMC 297583 (freier Volltext).
- M. Broccardo, V. Erspamer, G. Falconieri Erspamer, G. Improta, G. Linari, P. Melchiorri, P. C. Montecucchi: Pharmacological data on dermorphins, a new class of potent opioid peptides from amphibian skin. In: British journal of pharmacology. Band 73, Nummer 3, Juli 1981, S. 625–631, PMID 7195758, PMC 2071698 (freier Volltext).
- H. Mizoguchi, G. Bagetta, T. Sakurada, S. Sakurada: Dermorphin tetrapeptide analogs as potent and long-lasting analgesics with pharmacological profiles distinct from morphine. In: Peptides. Band 32, Nummer 2, Februar 2011, S. 421–427, doi:10.1016/j.peptides.2010.11.013, PMID 21126548 (Review).
- M. A. Robinson, F. Guan, S. McDonnell, C. E. Uboh, L. R. Soma: Pharmacokinetics and pharmacodynamics of dermorphin in the horse. In: Journal of Veterinary Pharmacology and Therapeutics. Band 38, Nummer 4, August 2015, S. 321–329, doi:10.1111/jvp.12179, PMID 25376170.
- G. Feuerstein: Dermorphin: autonomic pharmacology and structure-activity relationships. (Memento des Originals vom 23. Juli 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: NIDA research monograph. Band 69, 1986, S. 112–127, PMID 3093867.
- S. D. Heck, W. S. Faraci, P. R. Kelbaugh, N. A. Saccomano, P. F. Thadeio, R. A. Volkmann: Posttranslational amino acid epimerization: enzyme-catalyzed isomerization of amino acid residues in peptide chains. In: Proceedings of the National Academy of Sciences. Band 93, Nummer 9, April 1996, S. 4036–4039, PMID 8633012, PMC 39482 (freier Volltext).
- G. Kreil: Peptides containing a D-amino acid from frogs and molluscs. In: The Journal of biological chemistry. Band 269, Nummer 15, April 1994, S. 10967–10970, PMID 8157620 (Review).
- F. Guan, C. E. Uboh, L. R. Soma, M. Robinson, G. A. Maylin, X. Li: Detection, quantification, and identification of dermorphin in equine plasma and urine by LC-MS/MS for doping control. In: Analytical and bioanalytical chemistry. Band 405, Nummer 14, Mai 2013, S. 4707–4717, doi:10.1007/s00216-013-6907-0, PMID 23571464.
- W. Bogdanich: Turning to Frogs for Illegal Aid in Horse Races. In: New York Times, 19. Juni 2012.