Telaprevir
Telaprevir ist ein virenhemmend (virostatisch) wirksamer Arzneistoff aus der noch neuen Substanzklasse der HCV-Proteaseinhibitoren.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
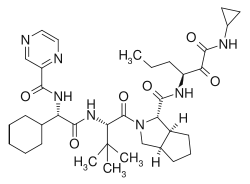 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Telaprevir | |||||||||||||||||||||
| Summenformel | C36H53N7O6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J05AE | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 679,9 g· mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Telaprevir wurde in den USA im Mai 2011 als Incivek® (Pharmazeutischer Unternehmer: Vertex Pharmaceuticals) und in der EU im September 2011 als Incivo® (Pharmazeutischer Unternehmer: Janssen-Cilag International N.V.) ausschließlich in Kombination mit den beiden antiviralen Wirkstoffen Peginterferon α und Ribavirin für die Behandlung der chronischen Hepatitis-C-Virusinfektion bei Erwachsenen zugelassen.[2] Vertex Pharmaceuticals hat die Vermarktung von Incivek® Ende 2014 eingestellt.[3][4] Janssen hat die Vermarktung von Incivo® in der EU 2016 eingestellt.[5]
Telaprevir ist oral wirksam.
Wirkungsmechanismus
Telaprevir hemmt die virale NS3.4A-Protease des Hepatitis-C-Virus (HCV) vom Genotyp 1, indem es reversibel an eine Seringruppe im aktiven Zentrum der Protease bindet. Die Bildung der viralen Proteine durch Zerlegung des primär gebildeten viralen Polyproteins wird dadurch an der Stelle der Abspaltung des Nicht-Strukturproteins 3 unterbunden und die Virusvermehrung in HCV-infizierten Wirtszellen wird blockiert.
Anwendungsgebiete
Telaprevir ist in Kombination mit Peginterferon-alfa und Ribavirin angezeigt zur Behandlung einer Infektion mit dem Hepatitis-C-Virus vom Genotyp 1 bei erwachsenen Patienten mit kompensierter Lebererkrankung (einschließlich Zirrhose), die entweder noch keine Behandlung erhalten haben, auf eine Behandlung nicht angesprochen oder aber einen Rückfall erlitten haben. Von einer kompensierten Lebererkrankung spricht man, wenn die Leber zwar geschädigt ist, aber noch eine normale Funktion aufweist.[6]
Die Wirksamkeit von Incivo wurde in placebokontrollierten Phase-III-Studien gezeigt, wobei in den Hauptstudien 1095 unbehandelte sowie 663 vorab erfolglos behandelte Patienten mit chronischer Infektion mit Hepatitis C vom Genotyp 1 und kompensierter Lebererkrankung teilnahmen. Alle Patienten erhielten außerdem Peginterferon α und Ribavirin. In einer weiteren Studie wurde die Wirkung unterschiedlich langer Peginterferon α /Ribavirin-Therapien (entweder 6 oder 12 Monate) in Kombination mit einer dreimonatigen Telaprevir-Behandlung verglichen. Der Hauptindikator für die Wirksamkeit war die Zahl an Patienten, bei denen sechs Monate nach dem Ende der Behandlung keine Virus-RNA im Blut mehr nachweisbar war (sustained virologic response, SVR).
In den Studien führte die zusätzliche Gabe von Telaprevir über drei Monate zusätzlich zur aktuellen Standardtherapie mit Peginterferon α und Ribavirin zu einem signifikant höheren dauerhaften virologischen Ansprechen (75 % bei erstmals behandelten Patienten, 88 % bei erfolglos vorbehandelten Patienten) im Vergleich zur alleinigen Anwendung der Standardtherapie (44 % bei erstmals behandelten Patienten, 24 % bei erfolglos vorbehandelten Patienten). Die dritte Studie ergab, dass bei mit Telaprevir behandelten Patienten eine sechsmonatige Peginterferon α/Ribavirin-Therapie ebenso wirksam war wie eine zwölfmonatige.
Anwendungsbeschränkungen und Nebenwirkungen
Telaprevir ist kontraindiziert bei Patienten mit entsprechender Überempfindlichkeit gegen den Wirkstoff, ferner bei gleichzeitiger Anwendung von Klasse-Ia oder -III-Antiarrhythmika. Wegen der zwingend gleichzeitig stattfindenden Behandlung mit Peginterferon α und Ribavirin verbietet sich dadurch die Anwendung von Telaprevir in der Schwangerschaft. Da Telaprevir einen starken Hemmstoff für die CYP3A darstellt, ist seine Anwendung bei gleichzeitiger Anwendung von Arzneistoffen, deren Clearance in hohem Maße vom gleichen Enzymsystem abhängt und bei denen erhöhte Plasmakonzentrationen schwerwiegende bzw. lebensbedrohliche Folgen haben können, ebenfalls kontraindiziert.
Es können zahlreiche Nebenwirkungen unter der Tripeltherapie Telaprevir/Peginterferon α/Ribavirin auftreten, unter denen Anämie, Hautausschlag, Thrombozytopenie, Lymphozytopenie, Juckreiz (Pruritus), Durchfall und Übelkeit am häufigsten beobachtet wurden. Die Hautreaktionen können mitunter sehr schwer sein, es sind bereits zwei Fälle einer toxischen epidermalen Nekrolyse (TEN) bekannt, wovon eine tödlich endete. Auch wenn die Umstände noch nicht ganz geklärt sind, liegt eine Warnung der Arzneimittelkommission der deutschen Ärzteschaft vor.[7]
Chemische Charakterisierung
Die synthetisch hergestellte Substanz Telaprevir hat sechs chirale Zentren und ist optisch aktiv. Die pharmakologische Wirksamkeit ist sehr abhängig von der Konformation des Moleküls, so weist beispielsweise das R-Diastereomer des Telaprevir namens VRT-127394 nur ein dreißigstel der Wirksamkeit von Telaprevir selbst auf.
Telaprevir ist so gut wie wasserunlöslich und mäßig löslich in Ethanol. Arzneilich verwendet wird eine wasserfreie kristalline Modifikation, die Form A.
Frühe Nutzenbewertung (§ 35a SGB V)
Eine Beschlussfassung hinsichtlich des Zusatznutzen von Telaprevir – aufgrund § 35a SGB V (AMNOG) (frühe Nutzenbewertung) – durch den Gemeinsamen Bundesausschuss (G-BA) fand Ende März 2012 statt.[8] Laut G-BA ist der Zusatznutzen für den Wirkstoff Telaprevir nicht quantifizierbar.[9][10] Eine eher positive Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) war vorher erfolgt.[11]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Informationen zu Incivo auf der Website der Europäischen Arzneimittelagentur.
- From Riches to Rags: Vertex Discontinues Incivek as Sales Evaporate. Abgerufen am 1. Dezember 2015.
- Telaprevir discontinued in Canada. Archiviert vom Original am 8. Dezember 2015. Abgerufen am 1. Dezember 2015.
- http://www.eatg.org/press/eatg-welcomes-the-removal-of-incivo-telaprevir-from-eu-markets/
- Fachinformation Incivo, akdae.de (PDF; 274 kB) Stand März 2012.
- Vorgehensweise bei Auftreten schwerer Hautreaktionen in Verbindung mit einer INCIVO Therapie (PDF; 361 kB).
- Informationsarchiv | Frühe Nutzenbewertung (§ 35a SGB V), WebSite des Gemeinsamen Bundesausschuss (G-BA).
- Frühe Nutzenbewertung: G-BA trifft sechs weitere Entscheidungen, Pressemitteilung G-BA vom 29. März 2012.
- BMG: Bekanntmachung eines Beschlusses (PDF; 388 kB), Veröffentlichung im Bundesanzeiger BAnz AT 10.05.2012 B3.
- Telaprevir: Zusatznutzen für bestimmte Patienten mit Hepatitis C, Pressemeldung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).