Rhesusfaktor
Die Rhesusfaktoren sind ein 1939 von Karl Landsteiner und Alexander Solomon Wiener gefundenes Erythrozyten-Antigen-System. Rhesus-positive Individuen besitzen spezielle Proteine auf der Zellmembran der Erythrozyten (roten Blutkörperchen), Rhesus-negative nicht.[1][2] Der Name stammt von der Gewinnung des ersten Testserums aus dem Blut von Kaninchen, die mit Erythrozyten aus Rhesusaffen (Macaca mulatta) behandelt worden waren.
| Blutgruppen-Polypeptid Rh(D), Rhesus-D Antigen | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 417 Aminosäuren | |
| Isoformen | Long, Short 1, Short 2 | |
| Bezeichner | ||
| Gen-Name | RHD | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Rhesus-Antigen | |
| Übergeordnetes Taxon | Chordatiere | |
| Blutgruppen-Polypeptid Rh(CE), Rhesus-C/E Antigen | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 417 Aminosäuren | |
| Isoformen | RHI, RHIV, RHVI, RHVIII | |
| Bezeichner | ||
| Gen-Name | RHCE | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Rhesus-Antigen | |
| Übergeordnetes Taxon | Chordatiere | |

Das Rhesus-Blutgruppensystem oder Rhesussystem bezeichnet das – nach dem AB0-System – zweitwichtigste Blutgruppensystem des Menschen. Es besteht insgesamt aus einer Gruppe von 50 zueinander ähnlichen Proteinen, deren fünf wichtigste Vertreter (C, c, D, E, e) mit Testseren geprüft werden können. Der älteste und wichtigste Rhesusfaktor hat die Abkürzung D im Rhesussystem:
- Besitzt eine Person das Rhesusfaktor-D-Antigen, so ist sie Rhesus-positiv, und man schreibt „Rh(D)+“, „Rh+“, „Rh“ oder – abhängig vom Genotyp – „Dd“, „dD“, „DD“, selten auch „RH1“.
- Besitzt eine Person kein Rhesusfaktor-D-Antigen, so ist sie Rhesus-negativ, und man schreibt „Rh(D)−“, „Rh−“, „rh“ oder „dd“.
Die Zugehörigkeit eines Menschen zu den fünf wichtigsten Faktoren C, c, D, E, e wird als Rhesusformel bezeichnet und etwa als ccD.Ee oder ccddee usw. dargestellt, siehe Abschnitte Vererbungsmuster und Rhesussystem.
Etwa 85 % der weißen europäischen und amerikanischen Bevölkerung sind Rhesus-positiv, etwa 15 % Rhesus-negativ. Fast 100 % aller Afrikaner, Asiaten und Ureinwohner Nord- und Südamerikas sind Rhesus-positiv.
Bedeutung für den Organismus
Nach einer Untersuchung aus dem Jahre 2009 mit genmanipulierten Mäusen, denen das Rhesusgen RHCG und damit Rhesusproteine fehlten, besitzen die Proteine wichtige Funktionen beim Transport von Ammonium-Ionen (NH4+) und Ammoniak (NH3), der Ausscheidung stickstoffhaltiger Stoffwechselendprodukte sowie der Aufrechterhaltung eines konstanten pH-Wertes im Blut. Die genveränderten Nager zeigten einen in den sauren Bereich verschobenen Blut-pH, im Urin niedrigere Spiegel stickstoffhaltiger Stoffe und bei Männchen weniger fruchtbare Spermien.[3]
Bedeutung bei Schwangerschaft und Bluttransfusion
Eine lebensbedrohliche Antigen-Antikörper-Reaktion kann bei wiederholter Bluttransfusion eines Rh-negativen Individuums mit Rh-positivem Blut oder ab der zweiten Schwangerschaft einer Rh-negativen Frau mit einem Rh-positiven Kind (s. Rhesus-Inkompatibilität) auftreten. Dabei bildet der Rhesus-negative Organismus Antikörper gegen die Rhesus-positiven Erythrozyten, und es kommt zur Hämagglutination (Spenderblutempfänger) oder Hämolyse (Kind).[1] Die Prävalenz der Blutgruppeninkompatibilität liegt in den westlichen Industriestaaten bei 1–1,5 von 1000 Schwangeren, der Anteil der Rhesus-Inkompatibilität beträgt davon 40–80 %.[4]
Rhesus-Negativ-Verbreitung
Etwa 17 % der Mitteleuropäer sind rhesus-negativ, in den östlichen Randzonen Europas ca. 4 %, im Baskenland 25 %, in der Schweiz etwa 15 %. Auf anderen Kontinenten liegt er zum Teil wesentlich niedriger. Amerika, Australien und ganz Ostasien haben gar keine Rhesus-negativen Ureinwohner.
Die Verbreitung von Personen mit Rhesus-negativem Blut spielt eine bedeutende Rolle bei der Ermittlung der genetischen Distanz von Völkern. Große Unterschiede zwischen Nationen bei der Häufigkeit Rhesus-negativen Blutes deuten auf große genetische Distanz und lassen gemäß den Untersuchungen von Cavalli-Sforza und anderen auf eine frühe Verzweigung der Völker schließen. Die Untersuchungen ergänzen Erkenntnisse, die sich aus der Studie über die Laktoseintoleranz ergeben.
Die Ursache für die starke Variation der RhD-Allele ist weiter ungeklärt und wirkte angesichts der Schadwirkung auf die Reproduktion mysteriös.[5][6][7] Es gibt jüngst erste Studien (2008/2009), die einen Zusammenhang mit der Toxoplasmose des Menschen herstellen[8][9][10] – demzufolge weisen RhD-heterozygote Toxoplasmose-infizierte Menschen in kritischen Situationen schnellere physische Reaktionen auf als die beiden RhD-homozygoten Träger, und können so den Effekt kompensieren, der sich modern in einer höheren Zahl von Verkehrsunfällen bei Toxoplasmose-Infektion zeigt. In Abwesenheit von Toxoplasmose zeigen Menschen ohne RhD-Allel (homozygot negativ) die besten Reaktionszeiten – die starke Verbreitung von Wildkatzen im afrikanischen Raum kann dort die Verbreitung des RhD-Allel stark befördert haben, während im europäischen Raum die Hauskatze erst seit antiker Zeit in das Lebensumfeld der Menschen gelangte.
Vererbungsmuster
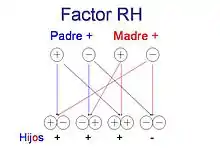
Die Vererbung des Rhesusfaktors ist dominant-rezessiv: Die Ausprägung des Faktors ist dominant gegenüber Rhesus-negativem Phänotyp.[11]
In einer (insbesondere Mehrfach-)Schwangerschaft kann sich dann eine ungünstige Konstellation ergeben, wenn die Mutter rhesusnegativ, das Antigen D fehlt, und der Vater (phänotypisch) rhesuspositiv, Antigen D vorhanden, ist. Wenn der Vater homozygot Rhesus-positiv ist, „DD“, wird er das Rhesus-Antigen D auf jeden Fall vererben und das Kind wird ebenfalls rhesuspositiv sein. Wenn der Vater heterozygot rhesuspositiv „Dd“ ist, so ist das Kind zu 50 % rhesuspositiv.
Anders als bei dem primär entdeckten Rh-Faktor „D“ stehen bei den Genprodukten des Rh-CE-Gens (wichtigste Antigenkombinationen sind CE, Ce, cE und ce) auch die kleinen Buchstaben für Antigene, die durch Testseren mit entsprechenden Antikörpern nachgewiesen werden können. Es gibt also neben dem Anti-C-Serum auch ein Anti-c-Serum etc. (Gleiches trifft auch für das Kell-System zu.) Auf standardkonformen deutschen Blutspendeausweisen stehen daher die Rhesusfaktoren scheinbar doppelt als „ccddee“. Die Kombinationsmöglichkeit macht das Rh-Blutgruppensystem zu einem der komplexesten menschlichen Blutgruppensysteme.
| Phänotyp in der Zelle exprimiert | Genotyp in der DNA exprimiert | Häufigkeit (%) † | |
|---|---|---|---|
| Fisher-Race Schreibung | Wiener Schreibung | ||
| D+ C+ E+ c+ e+ (RhD+) | Dce/DCE | R0RZ | 0,0125 |
| Dce/dCE | R0rY | 0,0003 | |
| DCe/DcE | R1R2 | 11,8648 | |
| DCe/dcE | R1r’’ | 0,9992 | |
| DcE/dCe | R2r’ | 0,2775 | |
| DCE/dce | RZr | 0,1893 | |
| D+ C+ E+ c+ e− (RhD+) | DcE/DCE | R2RZ | 0,0687 |
| DcE/dCE | R2rY | 0,0014 | |
| DCE/dcE | RZr’’ | 0,0058 | |
| D+ C+ E+ c− e+ (RhD+) | DCe/dCE | R1rY | 0,0042 |
| DCE/dCe | RZr’ | 0,0048 | |
| DCe/DCE | R1RZ | 0,2048 | |
| D+ C+ E+ c− e− (RhD+) | DCE/DCE | RZRZ | 0,0006 |
| DCE/dCE | RZrY | <0,0001 | |
| D+ C+ E− c+ e+ (RhD+) | Dce/dCe | R0r’ | 0,0505 |
| DCe/dce | R1r | 32,6808 | |
| DCe/Dce | R1R0 | 2,1586 | |
| D+ C+ E− c− e+ (RhD+) | DCe/DCe | R1R1 | 17,6803 |
| DCe/dCe | R1r’ | 0,8270 | |
| D+ C− E+ c+ e+ (RhD+) | DcE/Dce | R2R0 | 0,7243 |
| Dce/dcE | R0r’’ | 0,0610 | |
| DcE/dce | R2r | 10,9657 | |
| D+ C− E+ c+ e− (RhD+) | DcE/DcE | R2R2 | 1,9906 |
| DcE/dcE | R2r’’ | 0,3353 | |
| D+ C− E− c+ e+ (RhD+) | Dce/Dce | R0R0 | 0,0659 |
| Dce/dce | R0r | 1,9950 | |
| D− C+ E+ c+ e+ (RhD−) | dce/dCE | rrY | 0,0039 |
| dCe/dcE | r’r’’ | 0,0234 | |
| D− C+ E+ c+ e− (RhD−) | dcE/dCE | r’’rY | 0,0001 |
| D− C+ E+ c− e+ (RhD−) | dCe/dCE | r’rY | 0,0001 |
| D− C+ E+ c− e− (RhD−) | dCE/dCE | rYrY | <0,0001 |
| D− C+ E− c+ e+ (RhD−) | dce/dCe | rr’ | 0,7644 |
| D− C+ E− c− e+ (RhD−) | dCe/dCe | r’r’ | 0,0097 |
| D− C− E+ c+ e+ (RhD−) | dce/dcE | rr’’ | 0,9235 |
| D− C− E+ c+ e− (RhD−) | dcE/dcE | r’’r’’ | 0,0141 |
| D− C− E− c+ e+ (RhD−) | dce/dce | rr | 15,1020 |
†[12] Der R0-Haplotyp ist bei Menschen, deren Wurzeln südlich der Sahara liegen, viel weiter verbreitet.
Rhesussystem
| Genotyp | Rhesustyp | Rh(D) Test |
|---|---|---|
| ccddee | rr | Rh negativ |
| CcDdee | R1r | Rh positiv |
| CCDDee | R1R1 | Rh positiv |
| ccDdEe | R2r | Rh positiv |
| CcDDEe | R1R2 | Rh positiv |
| ccDDEE | R2R2 | Rh positiv |
Nach der Entdeckung der Blutgruppen A und B haben Landsteiner und Wiener ihre Arbeiten fortgesetzt. Im Gegensatz zu Antikörpern im AB0-Blutgruppensystem, die im Laufe des Säuglingsalters durch Kreuzreaktivität mit Bakterien, u. a. im Blut bestehen, sogenannte Isoagglutinine (Isohämolysine) oder regulären erythrozytäre Antikörper, entwickeln sich Antikörper gegen Rhesus-Antigene erst dann, wenn das Immunsystem mit fremden Rhesus-Antigenen in Kontakt gerät, etwa durch eine Bluttransfusion oder in einer Schwangerschaft; irreguläre erythrozytäre Antikörper.[13]
In der ersten Benennung durch Wiener stand das „R“ für das zuständige Gen bei Rhesusaffen, und das angehängte „h“ für das zugehörige Antiserum. Mit einem Locus stand „Rh“ nun für den positiven Test und „rh“ für den negativen Test. Da noch weitere Blutgruppenmerkmale gefunden wurden, setzte sich diese Bezeichnung als Rh-Faktor nicht durch, der sich auf den heutigen Rhesusfaktor D (auch Rh1 oder RhD genannt) bezieht. Durch die weitläufige Verwendung in der Fachliteratur blieb der Beiname jedoch erhalten.
Fisher und Race erkannten den Zusammenhang der weiteren Blutgruppenmerkmale und führten in Fortschreibung der bekannten A und B des AB0-System die Bezeichnungen C, D und E des Rhesussystems ein. Dabei gingen der Statistiker Fisher und Immunbiologe Race von drei Loci im Genom aus mit jeweils binären Ausprägungen der Gene als C/c, D/d und E/e. Erst später erkannte man, dass die Merkmale für C und E auf dem gleichen Locus liegen, und folglich in vier Alleltypen vorliegen. Die beiden Gene des Rhesussystems liegen auf Chromosom 1 bei 1p36.2-p34 (GeneID 6007 „RHD“ und GeneID 6006 „RHCE“).
Häufig wird bei der Angabe der D/d Gene nur zwischen negativ "dd" und positiv, geschrieben als "D." oder "D", unterschieden, letzteres steht dabei sowohl für "DD" als auch für "Dd", diese Unterscheidung ist jedoch erst durch eine (aufwändige/teure) exakte Genom-Analyse möglich. Beispiel: Im Blutspendeausweis steht ccDee oder ccD.ee, der Spender hat ccDdee oder ccDDee.
| RH positiv | |
|---|---|
| Cc D.ee | 35,0 % |
| CC D.ee | 18,5 % |
| Cc D.Ee | 13,0 % |
| cc D.Ee | 11,9 % |
| cc D.EE | 2,3 % |
| cc D.ee | 2,1 % |
| Cc D.EE | <1 % |
| RH negativ | |
| cc dd ee | 15,1 % |
| Cc dd ee | 0,76 % |
| cc dd Ee | 0,92 % |
Spätere gentechnische Untersuchungen konnten die bisherigen Vermutungen weitgehend bestätigen, in dem die Blutgruppen des Rhesussystems eng miteinander verwandt sind. Die resultierenden Proteine des Rhesussystems sind weitgehend homolog, sodass lange angenommen wurde, dass sie durch alternatives Splicing einer gemeinsamen langen Gensequenz entstehen, in deren Folge manchmal 1, 2 oder auch 3 Varianten in einem Organismus entstehen. Carritt et al. zeigten dann 1997 die Möglichkeit auf, dass das RhCE durch Genverdoppelung aus RhD entstanden ist, insbesondere nachdem im Genom des Menschen erstmals ein fehlendes Rhesusprotein auftrat. (in manchen entfernten Populationen gibt es bis heute keine RhD-negative Blutgruppen). Im Gegensatz zur Vermutung von Carrit et al. zeigten dann Willy A. Flegel und Wagner 2000, dass das RhCE das ursprüngliche Gen war, aus dem RhD verdoppelt wurde. Mehrere Teams zeigten 2000 außerdem, dass die Gene für RhCE und RhD eng beieinander und in entgegengesetzter Leserichtung liegen (die 3'-Enden liegen nebeneinander). So erklärt sich auch, dass eine ganze Reihe seltenerer Rhesusmerkmale gefunden werden konnten, in denen im RhCE-Protein anscheinend Exone des RhD-Proteins ausgeprägt sind.
Da neben den häufigen Ausprägungen des Rh-D- und Rh-CE-Gens weitere Wildtypen existieren, findet sich in der Literatur auch eine numerische Notation für die Blutgruppenmerkmale des Rhesussystems. Dabei steht D = RH1, C = RH2, E = RH3, c=RH4, e = RH5, … Cw = RH8 … mit heute über 50 Varianten. Wie diese tatsächlich im Genom ausgeprägt werden, ist bis heute nicht endgültig geklärt. Nichtmenschliche Modellorganismen wie die Maus sind dabei nicht vollständig zum Vergleich geeignet, da sie keine RhCE/RhD-Doppelung tragen.
Der Rhesusfaktor kommt in seltenen Fällen nur in quantitativ abgeschwächter Form vor (Du oder Dweak). Für die Bluttransfusion nehmen solche Patienten eine Mittelstellung zwischen Rh-positiv und Rh-negativ ein. Wenn sie Blut erhalten sollen, wird ihnen Rh-negatives Blut transfundiert. Im Gegensatz dazu gelten Patienten mit einem qualitativ veränderten D-Antigen, sog. Dpartial, als Rh-negativ.
Blutgruppenkompatibilität
Bei der Bluttransfusion wird im Regelfall blutgruppengleich transfundiert, auch hinsichtlich der Merkmale im Rhesussystem. Es herrscht jedoch ein Mangel an Rhd-negativen Blutspenden.
- Die Gabe Rhd-negativen Blutes an RhD-positive Patienten ist gesundheitlich unproblematisch; aufgrund der Verfügbarkeitssituation kommt dieses jedoch im Regelfall nicht vor.
- Die Gabe RhD-positiven Blutes an Rhd-negative Patienten wird wann immer möglich vermieden, lässt sich aufgrund des Mangels an Rhd-negativen Blutspenden jedoch oft nicht vermeiden. Wegen der Bedeutung in der Schwangerschaft wird Rhd-negativen Mädchen und gebärfähigen Frauen nur in lebensbedrohlichen Situationen RhD-positives Blut verabreicht. Nach Transfusion RhD-positiven Blutes an Rhd-negative Patienten erfolgt eine serologische Nachuntersuchung und bei Nachweis von Antikörpern wird der Patient über die Risiken beraten sowie diese Komplikation im Notfallpass vermerkt.[14]
Bei unklarem RhD-Test wird die Blutgruppe des Patienten daher meist als Rhd-negativ ausgewiesen.[15]
| Empfänger | Kompatible EK (Erythrozytenkonzentrate) |
|---|---|
| D-negativ | D-negativ, nur bei lebensbedrohlichen Situationen D-positiv |
| D-positiv | D-positiv, gegebenenfalls auch D-negativ (möglichst vermeiden, da D-negative EK rar sind) |
Quelle: [16]
Auch andere Rhesusfaktoren, neben dem bekannten Rhesus D, können zur Bildung von irregulären Antikörpern führen, also außer Anti-D noch anti-C, anti-c,anti-E, anti-e, die in unterschiedlich starkem Ausmaß hämolytische Transfusionsreaktionen hervorrufen. Dabei sind irreguläre Antikörper Antikörper der Klasse IgM oder IgG, letztere sind plazentagängig.
Konversion von Rhesus-negativ zu Rhesus-positiv
Einigen Medienberichten zufolge wurde in Sydney 2014 bei einem 15-jährigen Mädchen erstmals ein Fall einer Konversion eines ursprünglich Rhesus-negativen Patienten zu Rhesus-positiv infolge einer Organtransplantation dokumentiert, ohne dass dazu gezielt Blutzellen oder Knochenmarkzellen des Spenders übertragen wurden. Das Mädchen hatte fünf Jahre vorher eine Spenderleber eines Rhesus-positiven Spenders erhalten.[17][18] Ein Blutgruppenwechsel, sowohl von AB0-Antigenen als auch Rhesusmerkmalen, letztendlich bei allen nachweisbaren erythrozytären Antigenen, als Folge eines ärztlichen Eingriffs wird bei blutgruppenungleicher Blutstammzelltransplantation regelmäßig beobachtet. Bei der Auswahl der Blutstammzellspender ist die Identität der HLA-Antigene das primäre Kriterium, die Blutgruppe ist ein sekundäres Kriterium.[19]
Siehe auch
Literatur
- Willy A. Flegel: Genetik des Rhesus-Blutgruppensystems. The Genetics of the Rhesus Blood Group System. Deutsches Ärzteblatt 2007; 104(10): A-651 / B-573 / C-549 ( auf cdn.aerzteblatt.de)
- Klaus Schwarz: Molekulare Diagnostik und Pathophysiologie: Beispiele aus Hämatopoese, aus der Antigendiagnostik von Blutzellen und aus der Hämostaseologie Hämotherapie 14, 2010, S. 45–60 ( auf drk-haemotherapie.de) hier S. 52–53
Weblinks
Einzelnachweise
- Eintrag zu Rhesusfaktoren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juli 2011..
- Rhesusfaktor. In: Lexikon der Biologie, Wissenschaft Online; abgerufen am 17. März 2010
- S. Biver et al.: A role for Rhesus factor Rhcg in renal ammonium excretion and male fertility. In: Nature, 456, 2008, S. 339–343
- G.Crombach, G. Giers: Klinische Bedeutung der pränatalen Analyse des fetalen RhD-Genotyps bei Rhesus-Inkompatibilität. In: M.W. Beckmann, P. Dall, Peter Fasching, J.-S. Krüssel, D. Niederacher, B. Tutschek (Herausgeber): Molekulare Medizin in der Frauenheilkunde: Diagnostik und Therapie, S. 112.
- Haldane JBF: Selection against heterozygosis in Man.. In: Eugenics. 11, 1942, S. 333–340. doi:10.1111/j.1469-1809.1941.tb02297.x.
- RA Fisher, RR Race, GL. Taylor: Mutation and the Rhesus reaction. In: Nature. 153, 1944, S. 106. doi:10.1038/153106b0.
- CC Li: Is the Rh facing a crossroad? A critique of the compensation effect.. In: Am Naturalist.. 87, 1953, S. 257–261. doi:10.1086/281782.
- M Novotná, J Havlícek, AP Smith, P Kolbeková, A Skallová, J Klose, Z Gasová, M Písacka, M Sechovská, J Flegr: Toxoplasma and reaction time: Role of toxoplasmosis in the origin, preservation and geographical distribution of Rh blood group polymorphism. In: Parasitology. 135, Nr. 11, 2008, S. 1253–61. doi:10.1017/S003118200800485X. PMID 18752708.
- J Flegr, M Novotná, J Lindová, J Havlícek: Neurophysiological effect of the Rh factor. Protective role of the RhD molecule against Toxoplasma-induced impairment of reaction times in women. In: Neuroendocrinology Letters. 29, Nr. 4, 2008, S. 475–481. PMID 18766148.
- J Flegr, J Klose, M Novotná, M Berenreitterová, J Havlícek: Increased incidence of traffic accidents in Toxoplasma-infected military drivers and protective effect RhD molecule revealed by a large-scale prospective cohort study. In: BMC Infect. Dis.. 9, 2009, S. 72. doi:10.1186/1471-2334-9-72. PMID 19470165. PMC 2692860 (freier Volltext).
- Willy A. Flegel: Genetik des Rhesus-Blutgruppensystems. The Genetics of the Rhesus Blood Group System. In: Dtsch Arztebl, 2007, 104(10), S. A-651 / B-573 / C-549
- RR Race, AE Mourant: The Rh Chromosome Frequencies in England. (PDF) In: American Society of Haematology (Hrsg.): Blood. 3, Nr. 6, USA, 1948, S. 689–695. PMID 18860341. Abgerufen am 14. November 2010.
- Agathe Hajek-Rosenmayr: Die Bedeutung irregulärer Antikörper für die Bluttransfusion. Lab.med. 8:202-205(1984) ( auf degruyter.com)
- Cornelia Hofstaetter: Blutgruppeninkompatibilität. Update und Ausblick. Gynäkologie 2/2013, S. 6–9
- Hämotherapie. (Memento vom 7. Dezember 2012 im Internet Archive) (PDF; 361 kB) Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten. Abschnitt 4.3.5 Transfusion von Erythrozytenkonzentraten, Bundesärztekammer, Paul-Ehrlich-Institut, Änderungen und Ergänzungen 2010, erschienen Bundesanzeiger 2010; 62(101a): 4–36.
- Erwin Strobel, Wolfgang Schramm: Blutgruppenkompatible Auswahl der Blutprodukte. (PDF; 119 kB) In: Forum Hämotherapie, Bayrisches Ärzteblatt. 10/2003.
- Blutgruppe wechselt nach Lebertransplantation. In: Die Welt, 24. Januar 2008, abgerufen am 26. Mai 2013.
- Kate Sikora: Demi-Lee Brennan has changed blood types and immune system. In: The Daily Telegraph, 25. Januar 2008 (englisch).
- Kaimo Hirv: HLA-Merkmale und Knochenmarktransplantation. Zentrum für Humangenetik und Laboratoriumsdiagnostik (MVZ), abgerufen am 30. Juni 2014.