Boceprevir
Boceprevir ist ein virenhemmend (virostatisch) wirksamer Arzneistoff und der erste als solcher genutzte Vertreter der neuen Substanzklasse der HCV-Proteaseinhibitoren („first in class drug“).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
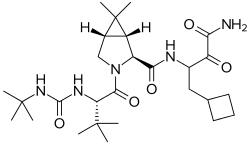 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Boceprevir | |||||||||||||||||||||
| Andere Namen |
(1R,2S,5S)-N-[(2Ξ)-4-Amino-1-cyclobutyl-3,4-dioxobutan-2-yl]-3-{(2S)-2-[(tert-butylcarbamoyl)amino]-3,3-dimethylbutanoyl}-6,6-dimethyl-3-azabicyclo[3.1.0]hexan-2-carboxamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C27H45N5O5 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J05AE12 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 519,7 g· mol−1 | |||||||||||||||||||||
| Löslichkeit |
schlecht löslich in Wasser,[1] gut löslich in Methanol, Ethanol und Isopropanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Als Victrelis(Pharmazeutischer Unternehmer: MSD Sharp & Dohme) wurde Boceprevir im Mai 2011 in den USA und im Juli 2011 in der EU für die Behandlung der chronischen Hepatitis-C-Virusinfektion, ausschließlich in Kombination mit den beiden Wirkstoffen Peginterferon alfa und Ribavirin, bei Erwachsenen zugelassen. MSD hat angekündigt die Vermarktung von Victrelis in den USA Ende 2015 einzustellen.[4]
Boceprevir ist oral wirksam.
Wirkungsmechanismus
Boceprevir hemmt die virale NS3-Protease des Hepatitis-C-Virus (HCV) vom Genotyp 1, indem es kovalent, aber reversibel an die Seringruppe (Ser139) im aktiven Zentrum der Protease bindet. Die Bildung der viralen Proteine durch Zerlegung des primär gebildeten viralen Polyproteins wird dadurch an der Stelle der Abspaltung des Nicht-Strukturproteins 3 (NS3) unterbunden und die Virusvermehrung in HCV-infizierten Wirtszellen wird blockiert.[5]
Die Kombination mit den beiden Standardarzneistoffen Peginterferon-alfa und Ribavirin soll eine Resistenzbildung verhindern.
Anwendungsgebiete
Boceprevir ist in Kombination mit Peginterferon-alfa und Ribavirin angezeigt zur Behandlung einer Infektion mit dem Hepatitis-C-Virus vom Genotyp 1 bei erwachsenen Patienten mit kompensierter Lebererkrankung, die entweder noch keine Behandlung erhalten haben, auf eine Behandlung nicht angesprochen oder aber einen Rückfall erlitten haben. Von einer kompensierten Lebererkrankung spricht man, wenn die Leber zwar geschädigt ist, aber noch eine normale Funktion aufweist.
Die Wirksamkeit von Victrelis wurde in zwei placebokontrollierten Phase-III-Studien gezeigt, an denen 1099 unbehandelte (SPRINT-2 Studie) sowie 404 vorab erfolglos behandelte Patienten (RESPOND-2 Studie) mit chronischer Infektion mit Hepatitis C vom Genotyp 1 und kompensierter Lebererkrankung teilnahmen. Alle Patienten erhielten außerdem Peginterferon alfa und Ribavirin. Der Hauptindikator für die Wirksamkeit war die Zahl an Patienten, bei denen 24 Wochen nach dem Ende der Behandlung kein Virus im Blut mehr nachweisbar war (sustained virologic response, SVR) und die daher als geheilt galten.
In beiden Studien führte die zusätzliche Gabe von Boceprevir über 44 Wochen zusätzlich zur aktuellen Standardtherapie mit Peginterferon alfa und Ribavirin zu einem signifikant höheren dauerhaften virologischen Ansprechen (66 % bei erstmals behandelten Patienten, 67 % bei erfolglos vorbehandelten Patienten) im Vergleich zur alleinigen Anwendung der Standardtherapie (38 % bei erstmals behandelten Patienten, 21 % bei erfolglos vorbehandelten Patienten).
Anwendungsbeschränkungen und Nebenwirkungen
Die Kombination Boceprevir/Peginterferon alfa/Ribavirin ist kontraindiziert bei Patienten mit entsprechender Überempfindlichkeit gegen einen der Wirkstoffe, bei Patienten mit Autoimmunhepatitis und in der Schwangerschaft. Da Boceprevir einen starken Hemmstoff für die CYP3A4/A5 darstellt, ist seine Anwendung bei gleichzeitiger Anwendung von Arzneistoffen, deren Clearance in hohem Maße vom gleichen Enzymsystem abhängt und bei denen erhöhte Plasmakonzentrationen schwerwiegende bzw. lebensbedrohliche Folgen haben können, ebenfalls kontraindiziert.
Es können zahlreiche Nebenwirkungen unter der Kombinationstherapie Boceprevir/Peginterferon alfa/Ribavirin auftreten, unter denen Erschöpfung, Anämie, Übelkeit, Kopfschmerz und Störungen der Geschmackempfindung (Dysgeusie) am häufigsten beobachtet wurden.
Bei der gleichzeitigen Anwendung von Boceprevir mit bestimmten Ritonavir-geboosterten HIV-Proteaseinhibitoren kann es zu Wechselwirkungen kommen, die sich in erniedrigten Plasmaspiegeln äußern.[6]
Chemische Charakterisierung
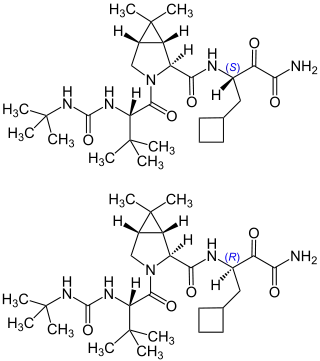
Die synthetisch hergestellte Substanz Boceprevir hat fünf chirale Zentren, von denen vier eine fixe Konfiguration einnehmen. Am dritten C-Atom, vom Ketoamid-Ende des Moleküls aus gerechnet, hingegen können die Substituenten eine (R)- oder (S)-Konfiguration annehmen. Der Arzneistoff stellt ein Gemisch der beiden diastereomeren Formen im Verhältnis von etwa 1:1 dar.
Das (S)-Isomer (Diastereomer SCH534128) stellt die pharmakologisch aktive Form dar, welches die NS3-Protease des Hepatitis-C-Virus um den Faktor 41 bis 130 mal stärker inhibiert als das (R)-Isomer (Diastereomer SCH534129).[7] In-vitro-Untersuchungen weisen darauf hin, dass beide Formen im Plasma wechselseitig ineinander übergehen (epimerisieren). In vivo stellen sich je nach Spezies unterschiedliche Gleichgewichte der Plasmaspiegel ein (z. B. beträgt das Verhältnis SCH534128:SCH534129 im Gleichgewicht bei Mäusen ca. 1,2:1, bei Ratten ca. 1:1, bei Affen ca. 1:5,9 und beim Menschen ca. 2,2:1).[1]
Boceprevir ist ein amorphes und durch Wasser schlecht benetzbares Pulver, das sich zudem schlecht in Wasser löst. Da Boceprevir keine ionischen Formen bildet, ist seine Löslichkeit pH-unabhängig. Boceprevir ist gut löslich in Methanol, Ethanol und Isopropanol.
Frühe Nutzenbewertung
Im Rahmen von § 35a SGB V (AMNOG) (frühe Nutzenbewertung) sah der Gemeinsame Bundesausschuss (G-BA) 2012 für Boceprevir gegenüber der zweckmäßigen Vergleichstherapie einen Hinweis auf einen nicht quantifizierbaren Zusatznutzen, und zwar sowohl für therapienaive als auch für therapieerfahrene Patienten.[8][9] Er folgte damit nicht der vorangegangenen Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), das einen Zusatznutzen lediglich für einen Teil der untersuchten Patientengruppen sah.[10]
Weblinks
- Informationen zu Victrelis auf der Website der Europäischen Arzneimittelagentur
Einzelnachweise
- Assessment report, Victrelis. (PDF; 2,8 MB) Ausschuss für Humanarzneimittel, 3. August 2011.
- Fachinformation zu Victrelis, Mai 2005. (Memento des Originals vom 12. November 2011 im Internet Archive; PDF; 444 kB) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. merck.com (englisch).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Merck Will No Longer Sell its Victrelis Hepatitis C Drug in the U.S. In: Wall Street Journal, 21. Januar 2015; abgerufen am 11. Juli 2021.
- Eintrag zu Boceprevir. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2019.
- Rote-Hand-Brief vom 23. Februar 2012 über mögliche Arzneimittelinteraktionen (PDF; 120 kB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Summary Basis of Decision (SBD) for VICTRELIS. (Memento des Originals vom 11. Januar 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Health Canada; Beurteilung der kanadischen Behörde für die Entscheidung über die Zulassung vom 22. Dezember 2011.
- Frühe Nutzenbewertung (§ 35a SGB V). Website des Gemeinsamen Bundesausschuss (G-BA), Informationsarchiv.
- Beschluss: Hinweis auf einen Zusatznutzen von Boceprevir (PDF; 307 kB) Gemeinsamer Bundesausschuss (G-BA).
- Boceprevir: Für bestimmte Patienten Hinweis auf Zusatznutzen. iqwig.de; abgerufen am 26. März 2020.