Guanazol
Guanazol ist eine heterocyclische Verbindung aus der Klasse der Triazole, wobei das symmetrische 1,2,4-Triazol (s-Triazol) an beiden Kohlenstoffatomen eine Aminogruppe trägt. Guanazol wirkt als Korrosionsinhibitor für Kupfer und als Antitumormittel. Es ist auch Ausgangsverbindung für porphyrinartige Makrocyclen und wegen seines hohen Stickstoffgehalts für Kondensationsprodukte als Vorstufen für Kohlenstoffnitride und für Explosivstoffe.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
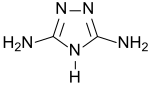 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Guanazol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H5N5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser und Ethanol, unlöslich in Diethylether, Chloroform und Benzol[2][5] | ||||||||||||||||||
| Brechungsindex |
1,7330 (25 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Die Synthese von Guanazol aus Dicyandiamid (DCDA) und Hydrazinhydrochlorid in Ethanol wurde von Guido Pellizzari erstmals 1894 beschrieben.[2]
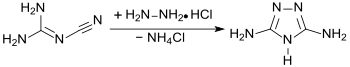
Bei Verwendung von Hydraziniumdichlorid in Wasser wird nach Neutralisierung mit Natronlauge Guanazol in 97%iger Ausbeute erhalten.[7]
Mit einem Überschuss an Dicyandiamid entsteht durch Umsetzung mit bereits gebildetem Guanazol das wasserunlösliche Guanazoguanazol, eine Vorstufe für Kohlenstoffnitride.[8]
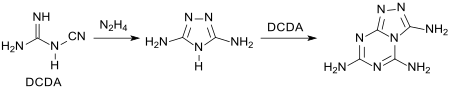
Eigenschaften
Guanazol ist ein farb- und geruchloser kristalliner Feststoff, der sich gut in Wasser löst (bis 15 Gew.%) und als wässrige Lösung alkalisch reagiert. Die Verbindung ist weniger löslich in Ethanol und praktisch unlöslich in unpolaren Lösungsmitteln, wie z. B. Diethylether, Chloroform und Benzol.[2]
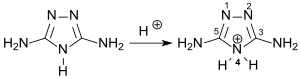
Guanazol liegt in einer Vielzahl möglicher tautomerer – durch Protonenwanderung entstehender – Molekülvarianten vor, darunter u. a. die abgebildeten (I), (II) und (III).
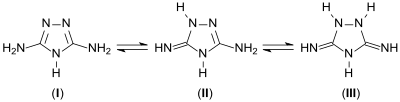
Die Substanz besitzt eine mit Melamin vergleichbare Basizität mit pKS-Werten von 4,43 und 5,00 und wird in der 4-Stellung des Triazolrings, nicht an den Aminogruppen protoniert.[9]
Anwendungen
Guanazol eignet sich als Korrosionsschutzmittel für Kupfer.[10]
Guanazol[11] und Derivate[12] wurden als Antitumormittel untersucht.
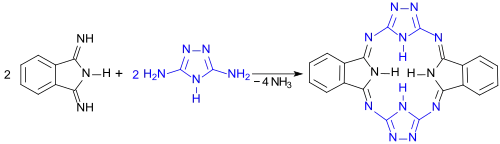
Der nicht-aromatische porphyrinartige Makrocyclus Triazolohemiporphyrazin ist durch Reaktion von Guanazol mit Phthalodinitril oder 1,3-Diiminoisoindolin in relativ hoher Ausbeute (75–80 %) zugänglich und komplexiert Schwermetallionen, wie z. B. Kupfer, Kobalt, Nickel, Zink u. a..[13]
Guanazol reagiert bei erhöhter Temperatur unter Abspaltung von Ammoniak über Guanazoguanazol zu Melem – einem brauchbaren Flammschutzmittel für Thermoplaste – und den so genannten Poly(heptazinimide)n als Vorstufen von Kohlenstoffnitriden.[8]
Über die mögliche Eignung von Guanazol in metallorganischen Gerüstverbindungen (engl. metal organic frameworks) MOFs für die CO2-Abscheidung aus Verbrennungsgasen wurde unlängst berichtet.[14]
Guanazol ist Ausgangsstoff für den stoßunempfindlichen Sprengstoff 5-Amino-3-nitro-1H-1,2,4-triazol (ANTA), wobei die beiden Aminogruppen zunächst mit Natriumnitrit (NaNO2) diazotiert und die entstehende Dinitroverbindung[15] anschließend mit Hydrazinhydrat selektiv (90 % Ausbeute) zum Aminonitrotriazol reduziert wird.[6]

Direkt aus Guanazol kann ANTA auch durch Oxidation mit 30%igem Wasserstoffperoxid in Gegenwart von Natriumwolframat (Na2WO4) als Katalysator in 60%iger Ausbeute erhalten werden.[16]
Von Stanley Miller und seiner Gruppe wurde im Rahmen ihrer Experimente zum präbiotischen Ursprung von Biomolekülen Guanazol als möglicher Baustein in RNA untersucht.[17]
Einzelnachweise
- Eintrag zu GUANAZOLE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- G. Pellizzari: Guanazolo e i suoi derivati alchilici. In: Gazz. Chim. Ital. Band 24, Nr. 1, 1894, S. 481–511.
- Eintrag zu 3,5-Diamino-1,2,4-triazole bei TCI Europe, abgerufen am 5. März 2021.
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 17.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–516.
- K.-Y. Lee, C.B. Storm, M.A. Hiskey, M.D. Coburn: An improved synthesis of 5-amino-3-nitro-1H-1,2,4-trialzole (ANTA). In: J. Energ. Mater. Band 9, Nr. 5, 1991, S. 415–428, doi:10.1080/07370659108019382.
- Patent US2648671: Preparation of guanazole. Angemeldet am 15. Juni 1951, veröffentlicht am 11. August 1953, Anmelder: American Cyanamid Co., Erfinder: J.J. Roemer, D.W. Kaiser.
- D. Dontsova, S. Pronkin, M. Wehle, Z. Chen, C. Fettkenhauer, G. Clavel, M. Antonietti: Triazoles: a new class of precursors for the synthesis of negatively charged carbon nitride derivatives. In: Chem. Mater. Band 27, Nr. 15, 2015, S. 5170–5179, doi:10.1021/acs.chemmater.5b00812.
- G. Léon, N. Paret, P. Fankhauser, D. Grenno, P. Erni, L. Ouali, D.L. Berthier: Formaldehyde-free melamine microcapsules as core/shell delivery systems for encapsulation of volatile active ingredients. In: RSC Adv. Band 7, Nr. 31, 2017, S. 18962–18975, doi:10.1039/C7RA01413A.
- A. Zarrouk, B. Hammouti, S.S. Al-Deyab, R. Salghi, H. Zarrok, C. Jama, F. Bentiss: Corrosion inhibition performance of 3,5-diamino-1,2,4-triazole for protection of copper in nitric acid solution. In: Int. J. Electrochem. Sci. Band 7, 2012, S. 5997–6011 (www.electrochemsci.org/papers/vol7/7075997).
- M.-A. Hahn, R.H. Anderson: Pharmacology of 3,5-diamino-1,2,4-trialzole (guanazole). I. Antitumor activity of guanazole. In: J. Natl. Cancer Inst. Band 48, Nr. 3, 1972, S. 783–790, doi:10.1093/juci/48.3.783.
- C.J. Kutz, S.L. Holshouser, E.A. Marrow, P.M. Woster: 3,5-Diamino-1,2,4-triazoles as a novel scaffold for potent, reversible LSD1 (KDM1A) inhibitors. In: Med. Chem. Commun. Band 5, Nr. 12, 2014, S. 1863–1870, doi:10.1039/C4MD00283K.
- F. Fernández-Lázaro, T. Torres, B. Hauschel, M. Hanack: Hemiporphyrazines as targets for the preparation of molecular materials: Synthesis and physical properties. In: Chem. Rev. Band 98, Nr. 2, 1998, S. 563–576, doi:10.1021/cr970002a.
- Z. Shi, Y. Tao, J. Wu, C. Zhang, H. He, L. Long, Y. Lee, T. Li, Y.-B. Zhang: Robust metal-triazolate frameworks for CO2 capture from flue gas. In: J. Amer. Chem. Soc. Band 142, Nr. 6, 2020, S. 2750–2754, doi:10.1021/jacs.9b12879.
- R. Haiges, G. Bélanger-Chabot, S.M. Kaplan, K.O. Christe: Preparation and characterization of 3,5-dinitro-1H-1,2,4-triazole. In: Dalton Trans. Band 44, Nr. 16, 2015, S. 7586–7594, doi:10.1039/C5DT00888C.
- T.D. Manship, D.M. Smith, D.G. Piercey: An improved synthesis of the insensitive energetic material 3-amino-5-nitro-1,2,4-triazole (ANTA). In: Propellants Explos. Pyrotech. Band 45, Nr. 60, 2020, S. 1621–1626, doi:10.1002/prep.202000097.
- V.M. Kolb, J.P. Dworkin, S.L. Miller: Alternative Bases in the RNA World: The Prebiotic Synthesis of Urazole and Its Ribosides. In: J. Mol. Evol. Band 38, 1994, S. 549–557, doi:10.1007/BF00175873.
