Benzoldicarbonitrile
Die Benzoldicarbonitrile bilden in der Chemie eine Stoffgruppe, die aus einem Benzolring mit zwei angefügten Nitrilgruppen (–CN) bestehen. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C8H4N2.
| Benzoldicarbonitrile | ||||||
| Name | Benzol-1,2-dicarbonitril | Benzol-1,3-dicarbonitril | Benzol-1,4-dicarbonitril | |||
| Andere Namen | o-Benzoldinitril, Phthalsäuredinitril, Phthalodinitril, 1,2-Dicyanbenzol |
m-Benzoldinitril, Isophthalsäuredinitril, Isophthalodinitril, 1,3-Dicyanbenzol |
p-Benzoldinitril, Terephthalsäuredinitril, Terephthalodinitril, 1,4-Dicyanbenzol | |||
| Strukturformel | 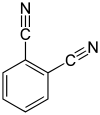 |
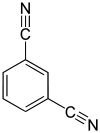 |
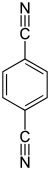 | |||
| CAS-Nummer | 91-15-6 | 626-17-5 | 623-26-7 | |||
| PubChem | 7042 | 12276 | 12172 | |||
| Summenformel | C8H4N2 | |||||
| Molare Masse | 128,13 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Kurzbeschreibung | beiges kristallines geruchloses Pulver |
farbloses kristallines Pulver mit Geruch nach bitteren Mandeln |
farblose Kristalle mit Geruch nach bitteren Mandeln | |||
| Schmelzpunkt | 138–141 °C[1] | 162–163 °C[2] | 224–227 °C[3] | |||
| Siedepunkt | 288 °C[2] | |||||
| Löslichkeit in Wasser |
0,56 g·l−1 (25 °C)[1] | 0,7 g·l−1 (20 °C)[2] | 0,08 g·l−1 (23 °C)[3] | |||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | 301+311+331‐412 | 302+332 | 315‐319‐335 | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 273‐501 | keine P-Sätze | 261‐305+351+338 | ||||
| MAK | Schweiz: 5 mg·m−3 (einatembarer Staub)[4] | |||||
| LD50 | 30 mg·kg−1 (Ratte, oral)[1] |
860 mg·kg−1 (Ratte, oral)[2] |
> 6400 mg·kg−1 (Ratte, oral)[3] | |||
Die Trivialnamen (Phthalsäuredinitril, Isophthalsäuredinitril, Terephthalsäuredinitril) leiten sich in entsprechender Weise von den Benzoldicarbonsäuren (Phthalsäure, Isophthalsäure, Terephthalsäure) ab.
Geschichte
Die erste Darstellung von Phthalonitril wurde 1896 durch Johannes Pinnow berichtet. Dabei wurde es als Nebenprodukt bei der Reaktion zwischen Orthoamidobenzonitrilhydrochlorid, Natriumnitrit und Salzsäure zur Synthese von Orthodicyanodiazoamidobenzen entdeckt.[5] Die erste direkte Methode zur Herstellung von Phthalonitril wurde im Jahre 1907 mit der Reaktion von Phthalamid mit Essigsäureanhydrid vorgestellt. Obwohl die ersten Erträge klein waren, wurde es zum Vorläufer der heutigen großtechnischen Syntheseverfahren.[6]
Darstellung
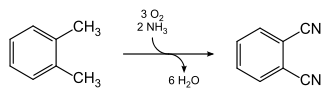
Phthalonitril kann in einem einstufigen Prozess durch Ammonoxidation von o-Xylol in Gegenwart eines Vanadium-Antimon-Oxid-Katalysators bei hohen Temperaturen (480 °C) gewonnen werden.[7]
Terephthalonitril kann gleichfalls durch Ammonoxidation von p-Xylol gewonnen werden.
Für die Herstellung von Phthalodinitril sind drei weitere Methoden beschrieben:[8]
- Aus Phthalsäureanhydrid und Ammoniak wird Phthalimid hergestellt, welches bei weiteren Zugabe von Ammoniak zu Phthalamid umgesetzt wird. Dieses wird in Pyridin oder Chlorbenzol als Lösungsmittel mit Dehydratationsmitteln, wie Phosphorpentachlorid behandelt, wobei Phthalodinitril entsteht.
- Unter Verwendung von Bauxit als Katalysator lässt man Phthalsäureanhydrid und Ammoniak in der Gasphase reagieren, wobei Phthalodinitril in einem Schritt entsteht.
- Durch Reaktion von Ammoniak mit einem Xylol-Gemisch werden Phthalodinitril, Isophthalodinitril und Terephthalodinitril erhalten. Von 1935 bis 1966 wurde Phthalodinitril bei der BASF AG aus Phthalsäureanhydrid hergestellt, ab 1966 erfolgte die Herstellung über o-Xylol durch Ammonoxidation bei Temperaturen bis zu 500 °C.
Eigenschaften
Terephthalonitril hat aufgrund der größten Molekülsymmetrie den höchsten Schmelzpunkt. o-Phthalodinitril ist gut löslich in Alkohol, Ether und Chloroform und sehr gut löslich in Benzonitril.[8]
Verwendung
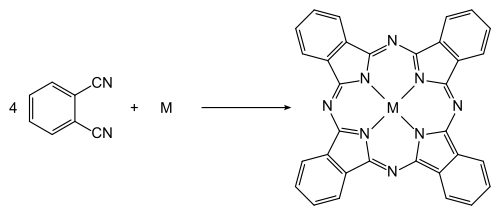
Phthalonitril wird zur Herstellung von Phthalocyanin-Farbstoffen verwendet und ist in elektrophotographischen Materialien enthalten.
Phthalodinitril wird auch zur Herstellung von Schädlingsbekämpfungsmitteln, als Stabilisierungszusatz für Flugzeugtreibstoffe und in der Gummiindustrie verwendet. Es dient weiterhin als Ausgangsprodukt zur Herstellung von optischen Aufhellern und Sensibilisatoren für die Fotografie.[8]
Weblinks
- Patent US4116999A: Recovery of Terphthalonitrile. Angemeldet am 28. April 1977, veröffentlicht am 26. September 1978, Anmelder: Lummus Co, Erfinder: Richard K. Barchas.
Einzelnachweise
- Eintrag zu CAS-Nr. 91-15-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Juli 2017. (JavaScript erforderlich)
- Eintrag zu CAS-Nr. 626-17-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Juli 2017. (JavaScript erforderlich)
- Eintrag zu CAS-Nr. 623-26-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Juli 2017. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 626-17-5 bzw. 1,3-Phthalsäuredinitril), abgerufen am 12. Februar 2020.
- Johannes Pinnow, C. Sämann: Ueber Derivate des o-Amidobenzonitrils; in: Berichte der Deutschen Chemischen Gesellschaft; 1896; 29 (1); S. 623–632; doi:10.1002/cber.189602901118.
- A. Braun, J. Tcherniac: Über die Produkte der Einwirkung von Acetanhydrid auf Phthalamid; in: Berichte der Deutschen Chemischen Gesellschaft; 1907; 40 (2); S. 2709–2714; doi:10.1002/cber.190704002202.
- Peter M. Lorz, Friedrich K. Towae, Walter Enke, Rudolf Jäckh, Naresh Bhargava, Wolfgang Hillesheim: Phthalic Acid and Derivatives. Ullmanns Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2002; doi:10.1002/14356007.a20_181.pub2.
- Toxikologische Bewertung von o-Phthalodinitril (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.