Phosphorylase-Kinase
Phosphorylase-Kinase ist ein Enzym, das das Enzym Glycogenphosphorylase phosphoryliert und damit aktiviert. Dadurch spielt sie im kaskadenförmigen Aktivierungsmechanismus des Glykogenabbaus von Tieren und Bakterien eine zentrale Rolle. Sie ist die erste Serin/Threonin-Kinase, die im Jahre 1959 von Edwin Gerhard Krebs und seinen Mitarbeitern entdeckt wurde.
| Phosphorylase-Kinase | ||
|---|---|---|
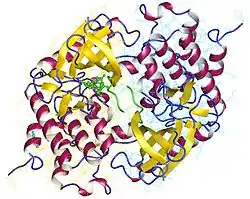 | ||
| Phosphorylase kinase (fragment) dimer, Oryctolagus cuniculus nach PDB 2PHK | ||
| Masse/Länge Primärstruktur | 10996 = 4*(1223+1092+386+148) Aminosäuren | |
| Sekundär- bis Quartärstruktur | (αβγδ)4 | |
| Isoformen | α2 (1235 aas); γ2 (406 aas) | |
| Bezeichner | ||
| Gen-Name(n) | PHKA1, PHKA2, PHKB, PHKG1, PHKG2 | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.11.19, Transferase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | 2 ATP + Phosphorylase b | |
| Produkte | 2 ADP + Phosphorylase a | |
| Vorkommen | ||
| Übergeordnetes Taxon | Tiere, Bakterien | |
Aufbau
Die Phophorylase-Kinase ist mit einer Masse von 1200 kD ein sehr großes Protein. Sie besitzt vier Untereinheiten, im Skelettmuskel liegt eine Untereinheitenstruktur von (αβγδ)4 vor. Dabei besitzt die β-Untereinheit eine katalytische Aktivität, die anderen Untereinheiten erfüllen regulatorische Funktionen. Bei der δ-Untereinheit handelt es sich um Calmodulin.
Regulation
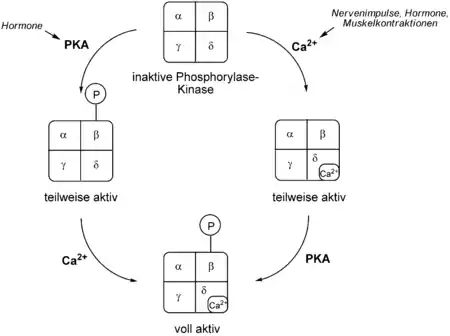
Das Enzym wird durch zwei Prozesse reguliert: durch reversible Phosphorylierung und durch allosterische Regulation.
Bei ersterem spielt die Proteinkinase A (PKA) eine entscheidende Rolle. Diese überträgt eine Phosphatgruppe auf die β-Untereinheit der zunächst schwach aktiven Phophorylase-Kinase. Dies hat zur Folge, dass das Aktivitätslevel der Kinase gesteigert wird. Die PKA selbst wird von einer inaktiven Form durch einen second messenger, cAMP, aktiviert. Ein Grund für cAMP-Freisetzung ist das Vorhandensein von Hormonen wie Adrenalin und Glucagon.
Die Phoshorylase-Kinase kann aber auch in eine teilweise aktive Form durch einen erhöhten Ca2+-Spiegel aktiviert werden. Als Calciumsensor dient Calmodulin, das der δ-Untereinheit des Enzyms entspricht.
Wenn sowohl die β-Untereinheit der Phosphorylase-Kinase in einer phosphorylierten Form vorliegt als auch das Calmodulin in der δ-Untereinheit Calciumionen gebunden hat, ist das Enzym voll aktiv.
Funktion
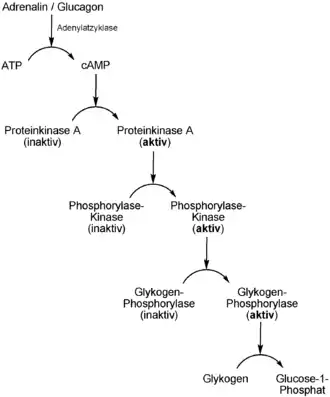
Der Glykogenabbau wird durch ein Hunger- oder Stresssignal über eine kaskadenförmige Signalübertragungsweg ausgelöst. Nach Binden des Hormons Adrenalin (Stresssignal) oder Glucagon (Hungersignal) wird cAMP als second messenger freigesetzt, welches wiederum die Proteinkinase A aktiviert. Wie oben beschrieben, phosphoryliert dieses die Phosphorylase-Kinase. Letztere phosphoryliert im aktivierten Zustand wiederum die inaktive Glykogenphosphorylase, ein dimeres Enzym. Inaktiviert wird es auch als Phosphorylase b bezeichnet, nach Phosphorylierung wird es in eine aktive Form (Phosphorylase a) umgewandelt. Durch die aktivierte Glykogen-Phosphorylase kann Glykogen zu Glucose-1-phosphat enzymatisch abgebaut und in weiteren Reaktionsschritten schließlich in Form von Glucose ins Blut abgegeben werden.
Damit nimmt die Phosphorylase-Kinase eine zentrale Rolle im Signaltransduktionsweg für den Glykogenabbau ein.
Literatur
- Berg, Tymoczko, Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3827413036