Glycolspaltung
Die Glykolspaltung ist die oxidative Spaltung vicinaler cis- und trans- Diole zu Carbonylverbindungen.
Übersichtsreaktion
Als Oxidationsmittel werden meist Blei(IV)-acetat oder meta-Periodsäure eingesetzt. Beide Methoden sind Namensreaktion der Organischen Chemie. Erfolgt die Glykolspaltung mit Blei(IV)-acetat, wird sie als Criegee-Reaktion bezeichnet. Die Reaktion wurde nach dem deutschen Chemiker Rudolf Criegee (1902–1975) benannt. Die Spaltung mit Periodsäure wurde von Léon Malaprade (1903–1982) entdeckt und wird darum als Malaprade-Reaktion bezeichnet.
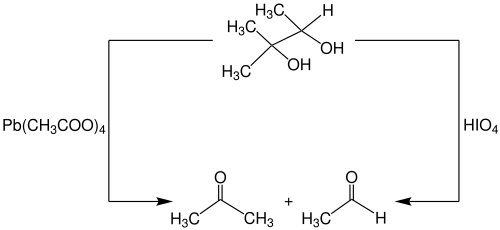
Reaktionsmechanismen
Die Reaktionsmechanismen beider Reaktionen sind nicht vollständig aufgeklärt. Die folgenden Mechanismen werden von mehreren Autoren für als am wahrscheinlichsten gehalten.
Criegee-Reaktion
Zunächst soll das vicinale cis-Diol 1 durch Blei(IV)-acetat gespalten werden. Hierfür wird in einer Gleichgewichtsreaktion ein Acetatrest durch das Diol protoniert, wodurch ein Essigsäuremolekül und das Alkoholat 2 entsteht. Durch die Ausbildung einer kovalenten Bindung zum positiv geladenen Blei(IV)-acetatkation wird in einer Additionsreaktion Verbindung 3 gebildet.[1]
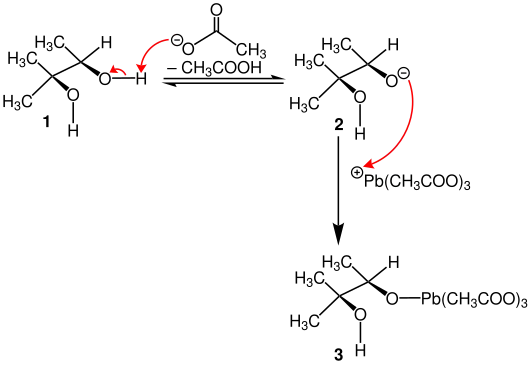
Im nächsten Schritt wird ein weiteres Acetatanion des Blei(IV)-acetats durch die zweite Hydroxygruppe protoniert. Das entstehende Alkoholat bildet ebenfalls eine kovalente Bindung zum Bleiatom aus. Unter erneuten Eliminierung eines Essigsäuremoleküls entsteht das fünfgliedrige, cyclische Intermediat 4. Durch Ringöffnung und unter Abspaltung von Blei(II)-acetat entsteht das Keton 5 und der Aldehyd 6. Je nachdem welche Reste gewählt werden, können auch zwei Ketone oder Aldehyde gewonnen werden.[2]

Für die Spaltung eines vicinalen trans-Diols 7 wird ein säurekatalysierter Mechanismus vorgeschlagen, der nicht über ein cyclisches Intermediat verläuft. Die Reaktion verläuft zunächst analog zur Spaltung eines cis-Diols.

Hier wird jedoch das mit einer Doppelbindung an das Kohlenstoffatom gebundene Sauerstoffatom des Acetatrestes protoniert. Auch hier wird ein Essigsäuremolekül sowie Blei(II)-acetat abgespalten. Die erhaltenen Produkte 5 und 6 bleiben gleich.
Malaprade-Reaktion
Der folgende Mechanismus gilt nur für cis-Diole. Auch hier wird die Periodsäure an eine der beiden Hydroxygruppen addiert.
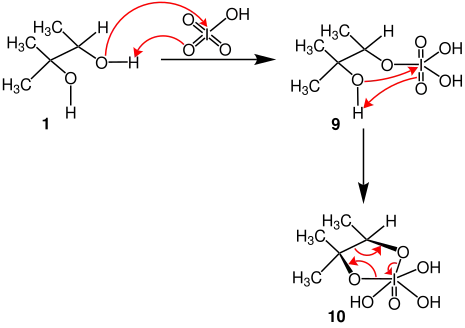
Durch die Protonierung einzelner Sauerstoffatome der Periodsäure wird das fünfgliedrige, cyclische Diester der Iod(VII)-säure 9 gebildet.[3]
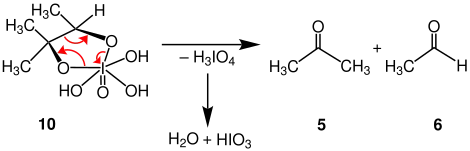
Durch Ringöffnung wird H3IO4 eliminiert, wodurch die Carbonylverbindungen 5 und 6 entstehen. H3IO4 zerfällt in Wasser und Iodsäure.
Praktische Bedeutung
Die Bedeutung der Reaktionen liegt vor allem im präparativen, analytischen und theoretischen Gebiet. Besonders kompliziert gebaute, aliphatische Aldehyde sind leichter zugänglich. Die Zucker-Chemie profitiert von der Reaktion, weil damit eine Analyse zur Aufklärung vicinaler und geminaler Diole erfolgen kann.[4][5] Somit wird die Konstitutionsermittlung durch die Glycolspaltung erleichtert. Die Malaprade-Reaktion brachte die acidemetrische Titration von Polyolen als neues Analysemittel hervor. Die Glykolspaltung war zur endgültigen Aufklärung der ersten Stufe der früher schwer zugänglichen alkoholischen Gärung von theoretischer Bedeutung. Die Spaltung mit wasserlöslichen Periodsäure ist eine gute Alternative um Saccharide zu spalten, weil diese in organischen Lösungsmitteln schwer zu lösen sind.[6] Bei gegen Säure empfindlichen Substanzen kann man auch Natriumperiodat verwenden. Wird die Glycolspaltung an Dextranen durchgeführt, werden hochmolekulare Polyaldehyde erhalten.[7] Diese sind in der Lage, Aminogruppen von Proteinen als Imine zu binden und dadurch Adjuvantien zu bilden.[8] Adjuvantien sind Hilfsstoffe, welche die Wirkung von Arzneimitteln oder Reagenzien verstärken. Darum spielt die Glycolspaltung auch in der Medizin eine wichtige Rolle.
Literatur
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism.Vol 1.Springer 2002, S. 85. ISBN 3-540-43024-5.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 1. John Wiley & Sons, Hoboken, New Jersey 2009, S. 761–764, ISBN 978-0-471-70450-8.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 2. John Wiley & Sons, Hoboken, New Jersey 2009, S. 1807–1810, ISBN 978-0-471-70450-8.
- S.K. Wiberg, S.W. Trahanovsky: Oxidation in organic chemistry, Vol 5(D). Academic Press, New York 1982, S. 27–37, ISBN 0-12-697253-2 (Pt. D).
- H.G. Maier: Lebensmittel- und Umweltanalytik : Methoden und Anwendungen, Vol 1. Steinkopf Verlag, Darmstadt 1990, S. 51, ISBN 3-7985-0789-9.
- T. Laue, A. Plagens: Namen- und Schlagwortreaktionen der organischen Chemie, Vol 5. Teubner Verlag, Wiesbaden 2006, S. 155–157, ISBN 3-8351-0091-2.
Einzelnachweise
- R. Criegee, E. Höger, G. Huber, P. Kruck, F. Marktscheffel, H. Schellenberger: Die Geschwindigkeit der Glykolspaltung mit Bleitetraacetat in Abhängigkeit von Konstitution und Konfiguration des Glykols. (III. Mitteilung), Justus Liebigs Annalen der Chemie 1956, 599, S. 82–124, doi:10.1002/jlac.19565990202.
- R. Criegee: Eine oxydative Spaltung von Glykolen (II. Mitteil. über Oxydationen mit Blei(IV)‐salzen), Berichte der deutschen chemischen Gesellschaft 1930, 64, S. 260–266, doi:10.1002/cber.19310640212.
- B. Sklarz: Organic chemistry of periodates, Royal Society of Chemistry 1967, 21, S. 3–28, doi:10.1039/QR9672100003.
- E. L. Jackson, C. S. Hudson: The Structure of the Products of the Periodic Acid Oxidation of Starch and Cellulose, Journal of the American Chemical Society 1938, 60, S. 989–991, doi:10.1021/ja01272a001.
- M. Abdel-Akher, F. Smith: Oxidation of Glycogen with Periodic Acid, Journal of the American Chemical Society 1958, 81, S. 1718–1721, doi:10.1021/ja01516a049.
- E. Baer, J.M. Grosheintz, H.O.L. Fischer: Oxidation of 1,2-Glycols or 1,2,3-Polyalcohols by Means of Lead Tetraacetate in Aqueous Solution, Journal of the American Chemical Society 1939, S. 2607–2609, doi:10.1021/ja01265a010.
- R.C. Hockett, M. Zief: Lead Tetraacetate Oxidations in the Sugar Group. XI. The Oxidation of Sucrose and Preparation of Glycerol and Glycol, Journal of the American Chemical Society 1949, 72, S. 2130–2132, doi:10.1021/ja01161a073.
- W.A. Krotoski, H.E. Weimer: Peptide-associated and antigenic changes accompanying periodic acid oxidation of human plasma orosomucoid, Archives of Biochemistry and Biophysics 1966, 115, S. 337–344, doi:10.1016/0003-9861(66)90284-0.