Berberin
Berberin ist ein Alkaloid aus der Gruppe der Isochinolinalkaloide. Es kommt unter anderem in den Pflanzen Berberitze (Berberis vulgaris), die dem Alkaloid den Namen gab, der Orangenwurzel (Hydrastis canadensis) und Coptis chinensis, im Wesentlichen in den Wurzeln, im Rhizom, im Stamm und in der Rinde, vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
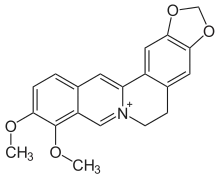 | |||||||||||||||||||
| Gegenion (meist Chlorid) nicht mitgezeichnet | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Berberin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C20H18ClNO4 (als Chlorid) | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgelber Feststoff (Hemisulfat)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 371,81 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Berberin ist kräftig gelb gefärbt, weshalb man früher die Berberitze zum Färben von Wolle und Leder benutzte. Noch heute wird in Nord-Indien Wolle mit Berberin gelb gefärbt. Unter UV-Licht fluoresziert Berberin kräftig gelb.[6] Es wird daher auch zur Anfärbung von Heparin in Mastzellen verwendet.[7] Als natürlicher Farbstoff hat Berberin den Colour Index CI 75160.
Vorkommen
Husemann[8] schreibt über das Berberin:


„Das Berberin ist eines der wenigen Alkaloide, die nicht nur über verschiedene Gattungen der nämlichen Pflanzenfamilie verbreitet sind, sondern selbst in Pflanzen der verschiedensten Familien vorkommen. Es findet sich in der Jamaikanischen Wurmrinde, der Rinde von Geoffroya jamaicensis Mur. oder Andria inermis Kuth. (Fam. Caesalpineae) nach Gastell, in der Rinde von Xanthoxylum clava Herculis L. (Fam. Xanthoxyleae) nach Perrins, in Podophyllum peltatum, Leontice thalictroides und Jeffersonia diphylla (Fam. Papaveraceae) nach F. F. Mayer (Amer. Journ. Pharm. XXXV. 97), in der westafrikanischen Abeocouta-Rinde von Coelocline polycarpa De C. (Fam. Anonaceae) nach Stenhouse, in den Wurzeln von Hydrastis canadensis L., Xanthorhiza Apiifolia Herit. und Coptis Teeta (Fam. Ranunculaceae) nach Mahla und Perrins in der Colombowurzel, der Wurzel von Cocculus palmatus De C. und in dem Ceylonischen Colomboholz, dem Holz von Coscinium fenestratum Colebr. (Fam. Menispermeae) nach Bödeker und Perrins, in Wurzel, Rinde, Blüten, unreifen Beeren und Blättern von Berberis vulgaris L., sowie auch in den indischen und mexikanischen Berberis-Arten (Fam. Berberidaceae) nach Buchner, Polex, Ferrein, Solley, Wittstein und anderen, nach Perrins endlich auch in der St. Johannswurzel vom Rio grande, in der Rinde des Pachnelo-Baumes von Bogota und in einem von den Einheimischen Woodunpar genannten gelben Farbholz aus Oberassam.“
Entdeckung
Berberin wurde 1830 von Johann Andreas Buchner und Johann Eduard Herberger aus der Wurzelrinde der Gewöhnlichen Berberitze (Berberis vulgaris L.) isoliert.[9] Schon 1824 hatte Karl Gustav Friedrich Hüttenschmid aus der Jamaikanischen Wurmrinde (Geoffroya jamaicensis) Jamaicin isoliert.[10] Gastell erkannte 1866, dass Jamaicin und Berberin identisch sind.
Eigenschaften
Berberin hat antiseptische, fungizide, gegenüber einigen Bakterien antibiotische,[11][12] sowie antiprotozoische[13] Eigenschaften. Es vermag durch Reaktion mit nukleophilen bzw. anionischen Gruppen von Eiweißen und Nukleinsäuren Enzyme wie die Natrium-Kalium-ATPase zu hemmen, was auf die quartäre Struktur (in der Iminium-Form vorliegend) zurückgeführt wird.[14] In Form des Berberinchlorids wurde die Substanz früher in Augentropfen bei Bindehautentzündung angewendet.[11] Im Orient kam Berberin ehemals in der Behandlung der Orientbeule zur Anwendung,[15] auch als Antimalariamittel wurde es eingesetzt.[12]
Gesundheitsbezogene Verwendung
Es existieren Berichte über vielfältige medizinische Anwendungen von Berberin, die sich auf vermeintliche Wirkungen beispielsweise auf den Zucker- und Lipidstoffwechsel, den Blutdruck und bei Hautgeschwüren bzw. wunder Haut gründen. Nach einer umfangreichen Stellungnahme der United States National Library of Medicine von 2019 wird jedoch keine dieser Anwendungen durch gute wissenschaftliche Nachweise gestützt.
- Für fünf Anwendungsgebiete wurde der dritte Grad auf einer sieben-stufigen Skala möglicher Wirksamkeit vergeben, nämlich Possibly Effective (möglicherweise wirksam).
- Für 19 Anwendungsgebiete wurde der letzte Grad vergeben, nämlich Insufficient Evidence to Rate (unzureichende Daten für eine Einschätzung).[16]
Toxizität
Berberin weist keine nennenswerte Toxizität auf.[17][18] Zu Fragen der Verträglichkeit bei medizinischer Anwendung gibt es nur vorläufige Einschätzungen, weshalb vor der Anwendung während Schwangerschaft und Stillzeit sowie bei Kindern abgeraten wird; auch können evtl. Wechselwirkungen mit bestimmten Medikamenten resp. Medikamentengruppen auftreten.[16]
Metabolismus
Berberin wird im Körper weitgehend metabolisiert. Weniger als 5 % der ursprünglichen Berberinmenge wurde bei Kaninchen im Urin, bei einer Gabe von 2 mg/kg intravenös, wieder gefunden.[19] Lediglich 0,5 % Berberin wurden im selben Versuch über die Galle und den Intestinaltrakt ausgeschieden, womit nur 5,5 % des oral aufgenommenen Berberins unverändert den Körper verließen.
In der Leber wird Berberin in der Phase I von Cytochrom P450 demethyliert und in Phase II glucuronidiert, das heißt mit Glucuronsäure umgesetzt.[20] Entsprechend sind im Plasma von Ratten die Metaboliten: Berberrubin[21] (einfach demethyliertes Berberin), Thalifendin[22] und Jatrorrhizin[23], frei oder an Glucuronsäure gebunden, nachweisbar.[24]
Synthese
Biosynthese

Die Syntheseschritte von Berberin in den Berberitzen geht über zehn Stufen und wurde Anfang der 1990er-Jahre aufgeklärt.[25] Die beiden Ausgangsverbindungen sind dabei 4-Hydroxyphenylacetaldehyd und Dopamin, die im ersten Schritt in einer Kondensationsreaktion Norcoclaurin bilden. Das wird monomethyliert und bildet dabei Coclaurin. Nach zwei weiteren Schritten bildet sich Reticulin, aus dem wiederum Scoulerin entsteht. Über eine weitere Zwischenstufe entsteht Canadin, aus dem letztlich das Berberin entsteht.[26]
Literatur

- M. Imanshahidi und H. Hosseinzadeh: Pharmacological and therapeutic effects of Berberis vulgaris and its active constituent, berberine. In: Phytother Res 22, 2008, S. 999–1012; PMID 18618524.
- K. Hayashi u. a.: Antiviral activity of berberine and related compounds against human cytomegalovirus In: Bioorg Med Chem Lett 17, 2007, S. 1562–1564; PMID 17239594.
- S. K. Mantena: Berberine, a natural product, induces G1-phase cell cycle arrest and caspase-3-dependent apoptosis in human prostate carcinoma cells. In: Mol Cancer Ther 5, 2006, S. 296–308; PMID 16505103.
- R. Ovádeková u. a.: Nanostructured electrochemical DNA biosensors for detection of the effect of berberine on DNA from cancer cells. In: Anal Bioanal Chem 386, 2006, S. 2055–2062; PMID 17053918.
- T. Efferth u. a.: Molecular determinants of response of tumor cells to berberine. In: Cancer Genomics Proteomics 2, 2005, S. 115–124.
- H. H. Yu: Antimicrobial activity of berberine alone and in combination with ampicillin or oxacillin against methicillin-resistant Staphylococcus aureus. In: J Med Food 8, 2005, S. 454–461; PMID 16379555.
- K. Weijia u. a.: Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins. In: Nature Medicine 10, 2004, S. 1344–1351; PMID 15531889.
- C. C. Lin u. a.: Cytotoxic effects of Coptis chinensis and Epimedium sagittatum extracts and their major constituents (berberine, coptisine and icariin) on hepatoma and leukemia cell growth. In: Clin Exp Pharmacol Physiol 31, 2004, S. 65–69; PMID 14756686.
- C. W. Lau u. a.: Cardiovascular actions of berberine. In: Cardiovasc Drug Rev 19, 2001, S. 234–244; PMID 11607041.
- C. W. Wright u. a.: In vitro antiplasmodial, antiamoebic, and cytotoxic activities of some monomeric isoquinoline alkaloids. In: J Nat Prod. 63, 2000, S. 1638–1640; PMID 11141105.
- H. L. Lin u. a.: Berberine modulates expression of mdr1 gene product and the responses of digestive track cancer cells to Paclitaxel. In: British Journal of Cancer 81, 1999, S. 416–422; PMID 10507765; PMC 2362909 (freier Volltext).
- G. H. Rabbani u. a.: Randomized controlled trial of berberine sulfate therapy for diarrhea due to enterotoxigenic E. coli and Vibrio cholerae. In: The Journal of Infectious Diseases 155, 1987, S. 979–984; PMID 3549923.
- H. Schmitz: Zur Beeinflussung des Zellstoffwechsels durch Berberin. In: Zeitschrift für Krebsforschung 57, 1950, S. 137–141. doi:10.1007/BF00524722
Einzelnachweise
- Datenblatt Berberine hemisulfate salt bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- Eintrag zu Berberin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Yakugaku Zasshi. Journal of Pharmacy. Vol. 82, S. 726, 1962.
- Kiso to Rinsho. Clinical Report. Vol. 8, S. 654, 1974.
- Dissertationes Pharmaceuticae. Vol. 17, S. 429, 1965.
- Fluoreszenzfarbstoffe in der Natur. Abgerufen am 31. Dezember 2009.
- Datenblatt Berberine chloride form bei Sigma-Aldrich, abgerufen am 31. Dezember 2009 (PDF).
- A. Husemann und T. Husemann, Die Pflanzenstoffe in chemischer, physiologischer, pharmakologischer und toxikologischer Hinsicht, Berlin, 1871, S. 245 Digitalisat Bayerische Staatsbibliothek
- Johann Andreas Buchner und Johann Eduard Herberger. Chemische Abhandlung über die Berberitzen-Wurzel. In: J. A. Buchner (Hrsg.) Repertorium für die Pharmacie, Schrag, Nürnberg 1830 (Band 36), S. 1–53 (Digitalisat)
- Jamaicin und Surinamin, zwei neue Pflanzenstoffe, aufgefunden von Dr. Hüttenschmid aus Zürich. In: Peter Jonas Bergius und John Adamson (Hrsg.) Magazin für Pharmacie und die dahin einschlagenden Wissenschaften. 2. Jahrgang (Band 7), Chr. Fr. Müller, Karlsruhe 1824, S. 251–256 (Digitalisat); S. 283–289: Besprechung der Dissertation (Digitalisat)
- T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier 2004, ISBN 3-8274-1481-4, S. 469–470.
- Römpp Lexikon Chemie, 10. Auflage, 1996–1999: Band 1. S. 407.
- Y. Kaneda u. a.: In vitro effects of berberine sulphate on the growth and structure of Entamoeba histolytica, Giardia lamblia, and Trichomonas vaginalis. In: Annals of Tropical Medicine and Parasitology 85, 1991, S. 417–425; PMID 1796883.
- E. Teuscher: Biogene Arzneimittel. 5. Auflage, Wissenschaftliche Verlagsgesellschaft, 1997, S. 325 f. ISBN 3-8047-1482-X.
- Harry Auterhoff: Lehrbuch der Pharmazeutischen Chemie, 9. Auflage 1977, WVG Stuttgart. S. 335.
- Berberine: MedlinePlus Supplements. MedlinePlus, National Library of Medicine, US National Institutes of Health. 19. Januar 2019., abgerufen 13. April 2020.
- Berberine. PubChem, National Library of Medicine, US National Institutes of Health. 9. März 2020., abgerufen 13. April 2020.
- Berberine. NCBI, National Center for Biotechnology Information. 6. Oktober 2020., abgerufen 13. Januar 2021.
- C.M. Chen und H.C. Chang: Determination of berberine in plasma, urine and bile by high-performance liquid chromatography. In: J. Chromatogr. B 665, 1995, S. 117–123; PMID 7795781.
- P. L. Tsai u. a.: Hepatobiliary excretion of berberine. In: Drug Metab Dispos 32, 2003, S. 405–412; PMID 15039293.
- Externe Identifikatoren von bzw. Datenbank-Links zu Berberrubinchlorid: CAS-Nummer: 15401-69-1, Wikidata: Q72443285.
- Externe Identifikatoren von bzw. Datenbank-Links zu Thalifendin: CAS-Nummer: 18207-71-1, PubChem: 3084288, Wikidata: Q83041334.
- Externe Identifikatoren von bzw. Datenbank-Links zu Jatrorrhizin: CAS-Nummer: 3621-38-3, EG-Nummer: 222-817-3, ECHA-InfoCard: 100.020.744, PubChem: 72323, ChemSpider: 65269, Wikidata: Q10910369.
- F. Zuo u. a.: Pharmacokinetics of Berberine and Its Main Metabolites in Conventional and Pseudo Germ-Free Rats Determined by Liquid Chromatography/Ion Trap Mass Spectrometry. In: Drug Metabolism and Disposition 34, 2006, S. 2064–2072; PMID 16956957.
- J. A. Bjorklund: Cryptic Stereochemistry of Berberine Alkaloid Biosynthesis. In: J. Am. Chem. Soc. 1995, 117 1533–1545 doi:10.1021/ja00110a009.
- Biosynthesis of isoquinoline alkaloids. (PDF; 995 kB) vom 18. Oktober 2006.
- A. Pictet und A. Gams. In: Ber. Dtsch. Chem. Ges. 43, 1910, S. 2384–2391.
- C. D. Gilmore u. a.: Orthogonal Synthesis of Indolines and Isoquinolines via Aryne Annulation. In: Journal of the American Chemical Society 130, 2008, S. 1558–1559; doi:10.1021/ja0780582.
