Dolutegravir
Dolutegravir (Tivicay®) ist ein Arzneistoff aus der Gruppe der INSTI (englisch integrase strand transfer inhibitor, neben Raltegravir und Elvitegravir), der in der Behandlung von HIV eingesetzt wird. Zur Anwendung kommt das Natriumsalz, das im August 2013 zugelassen wurde[4] und von GlaxoSmithKline vermarktet wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
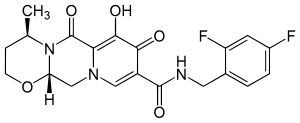 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dolutegravir | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H19F2N3O5 | |||||||||||||||||||||
| Kurzbeschreibung |
orange Farbe[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 419,38 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Dolutegravir ist ein Inhibitor der viralen Integrase von HIV 1, und findet seinen Einsatz in der Behandlung von mit HIV 1 infizierten Patienten ab dem 12 Lebensjahr. Die Therapie erfolgt grundsätzlich nur in Kombination mit anderen HAART-Medikamenten (Hochaktive-antiretrovirale Kombinationstherapie). Mit Stand 2017 wird Dolutegravir zusammen mit Lamivudin (Zeffix® / Epivir®) und Abacavir (Ziagen®) beide aus der Gruppe der Nukleosidischen-Reverse-Transkriptase-Inhibitoren (NRTI) in Form einer einzelnen, einmal täglich einzunehmenden Tablette (Single Drug Regime) unter dem Handelsnamen Triumeq® vermarktet. Darüber hinaus wird Dolutegravir auch einzeln als Tivicay® angeboten. Neben Dolutegravir ist Elvitegravir der momentan einzig weitere Vertreter in dieser Generation dieser Wirkstoffklasse der INSTI. Dolutegravir ist jedoch auf Grund seiner pharmakologischen Eigenschaften bei AUC als auch der Plasma und Intrazellulären Halbwertzeit deutlich überlegen, da Elvitegravir durch einen sogenannten Booster wie z. B. Cobicistat oder Ritonavir, der den Metabolismus von Elvitegravir durch Hemmung des Isoenzyms CYP3A4 (aus der Cytochrom P450 Familie) stark inhibiert, kombiniert werden muss, um eine ausreichende AUC und eine verlängerte für das das Single-Drug-Regime geeignete Halbwertzeit zu erreichen. Dolutegravir hingegen besitzt eine Halbwertzeit von 13–15 Stunden. Daher wird Dolutegravir ohne Booster, nur einmal täglich verabreicht. Darüber hinaus bietet Dolutegravir p.o. eine gute Bioverfügbarkeit auch unabhängig von einer etwaigen Nahrungszufuhr und kann daher unabhängig von dieser verabreicht werden.
Unerwünschte Wirkungen (Nebenwirkungen)
Als unerwünschte Nebenwirkungen können auftreten:[5][6]
- Sehr häufig: Kopfschmerzen, Durchfall und Übelkeit.
- Häufig: Hautausschlag, Juckreiz, Erbrechen, Magenschmerzen, Schlafstörungen, Schwindel, Abnormale Träume, Depression, Angstzustände, Erschöpfung, Blähungen, Anstieg der Leberenzyme und Anstieg von Kreatin-Phosphokinase.
- Gelegentlich: Hepatitis, Gelenkschmerzen, Muskelschmerzen. Außerdem Suizidversuch und Suizidgedanken (vor allem bei zuvor schon psychisch Erkrankten, z. B. an Depression)
- Selten: Leberversagen
außerdem
- Hypersensitive Reaktionen: 1 % oder weniger in klinischen Studien der Phase 3
- Beeinflussung der Serum-Leberwerte bei Patienten mit Hepatitis-B- oder C-Koinfektion: erhöhtes Risiko des Anstieges der Serum-Transaminase
- Umverteilung oder Akkumulation von Körperfett
- Immune Reconstitution Syndrome
Teratologie
Bei Einnahme von Dolutegravir in den ersten Monaten der Schwangerschaft wurde ein leicht erhöhtes Risiko von Fehlbildungen beobachtet, insbesondere kommt es häufiger zu Neuralrohrdefekten, wie Spina bifida. In einer Beobachtungsstudie in Botswana mit fast 120.000 Geburten wurde ein Neuralrohrdefekt bei 0,08 % aller Kinder von nicht HIV-infizierten Müttern gefunden, bei 0,10 % aller Kinder von HIV-infizierten Müttern, deren antiretrovirale Therapie zum Zeitpunkt der Konzeption nicht Dolutegravir enthielt, und bei 0,30 % aller Kinder, deren HIV-infizierte Mütter zum Zeitpunkt der Konzeption Dolutegravir einnahmen, was eine Erhöhung um 0,20 Prozentpunkte ausmacht. Vermutet und in Zellkulturen gezeigt wurde ein Folsäure-Antagonismus.[7]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
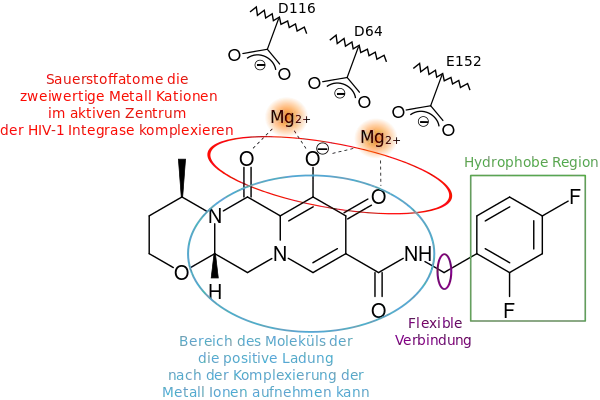
Dolutegravir ist ein Integrase-Strang-Transfer-Inhibitor der zweiten Generation und stellt eine Weiterentwicklung der bereits bestehenden Wirkstoffklasse der Integrase-Inhibitoren dar, wobei Raltegravir (Isentress) der einzige Vertreter seiner Klasse der ersten Generation darstellt. Dolutegravir wird in Medikamenten als Natrium-Salz verabreicht. Die Manipulation der viralen Integrase (virales Protein), stellt einen wichtigen therapeutischen Eingriff in Replikation des HI-Virus innerhalb der T-Zellen mit retroviraler DNA (reverse transkriptierter Virus-RNA nach DNA) dar. Sie ist als Nukleotidyltransferase für den Einbau viraler DNA-Stränge in das Chromosom der Zelle verantwortlich, und somit also neben der Protease und der Reverse-Transkriptase eines der drei Schlüsselmoleküle, das bei der Replikation von HI-Viren eine Rolle spielt. Als Endonuklease ist sie in der Lage, das menschliche Chromosom zu schneiden und die neu entstandene virale DNA einzufügen.
Dolutegravir hat außerdem die Eigenschaft, weniger anfällig für Resistenzen durch Mutationen in Folge nicht vollständig inhibierter Virusreplikation zu sein. Diskutiert wird, dass sich Dolutegravir stärker an die virale Integrase bindet. Die dissoziative Halbwertszeit ist länger als im Vergleich zu Elvitegravir und Raltegravir und gleicht somit Mutationen aus, die die antivirale Wirkung herabsetzen.[8]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Der Arzneistoff besitzt eine Halbwertszeit von 13 bis 15 Stunden. Mehr als 30 Stunden bleibt die Plasmakonzentration über dem IC90-Wert. Das heißt, die Virusreplikation wird in diesem Zeitraum zu 90 % gehemmt. Die Wirksamkeit und Sicherheit wurde von vier Phase-III-Studien bewiesen mit einer Teilnehmerzahl von 2553 HIV-Patienten. Dolutegravir konnte, verglichen mit Raltegravir, einem INSTI der ersten Generation, die Viruslast vergleichbar effektiv senken, im Vergleich zu Atripla sogar signifikant effektiver.
Dolutegravir hemmt den organic cation transporter 2, was zu einer erniedrigten tubulären Sekretion von Kreatinin, und so zu einer Erhöhung des Serumkreatinin-Wertes führt, wobei dies jedoch nicht mit einer verringerten glomerulären Filtrationsrate oder eventuellen Nierenschäden in Verbindung gebracht werden konnte.
Der Abbau erfolgt über Uridindiphosphat-Glucuronosyltransferase 1A1 und Isoenzym CYP3A4 der Cytochrom P450 Familie. Dabei werden CYP-Isoenzyme weder inhibiert noch induziert. Bestimmte Nahrungsergänzungsmittel und andere Medikamente können die Absorption von Dolutegravir aus dem Darm nach oraler Aufnahme stark vermindern. Hierzu zählen u. a. Eisen und calciumhaltige Nahrungsergänzungsmittel bzw. Multivitaminpräparate die Calcium und Eisen enthalten. Die Einnahme von Dolutegravir sollte daher 4 Stunden vor oder 6 Stunden nach der Einnahme entsprechender Präparate erfolgen. Vorsicht geboten ist bei Arzneimitteln von denen bekannt ist, dass sie Induktoren von Isoenzym CYP3A4 sind, da Sie die Plasmakonzentration von Dolutegravir stark herabsetzen und zu einem Therapieversagen durch Resistenzentwicklung führen können. Sollte die gleichzeitige Einnahme von Medikamenten erforderlich sein die CYP3A4 induzieren, so ist eine Dosisanpassung von Dolutegravir erforderlich. Zu den Induktoren von CYP34A gehören unter anderem: (Auflistung nicht abschließend...) Antazida, Rifampicin, Johanniskraut und bestimmte Antiepileptika. Hingegen können Inhibitoren wie z. B. Cobicistat, oder Ritonavir (Auflistung nicht abschließend...) einen starken Anstieg von Dolutegravir und einer verlängerten Halbwertzeit mit dem Auftreten von unerwünschten Nebenwirkungen und / oder der Verstärkung von vorhandenen Nebenwirkungen führen. In Tierexperimenten an Ratten, und Affen konnte trotz hoher Überdosierung (dem 24 bis 27 der human therapeutisch empfohlenen Tagesdosis) jedoch keine Toxizität festgestellt werden. Lediglich bei trächtigen Kaninchen wurde eine maternale Toxizität beobachtet. (Verminderte Futteraufnahme, reduzierte Gewichtszunahme, verminderte Harnausscheidung) In einer Langzeitstudie über 26 Wochen an Ratten und 38 Wochen an Affen kam es mit den zuvor genannten Überdosierungen zu gastrointestinalen Störungen die vermutlichen auf die orale Applikation zurückzuführen sind.[9]
Weiterhin können unerwünschte Wechselwirkungen mit Reverse-Transkriptase-Inhibitoren wie Etravirin und Efavirenz sowie mit Proteaseinhibitoren wie Forsamprenavir entstehen (...Auflistung nicht abschließend). Es sind unter Umständen Dosiserhöhungen auf die zweifache Tagesdosis erforderlich bzw. die gleichzeitige Einnahme aufgrund fehlender klinischer Studien sicherheitshalber zu unterlassen.[8][10][5]
In-vitro an Bakterien und Säugerzellkulturen sowie in-Vivo bei Micronukleustest an Nagetieren hat sich Dolutegravir bei Langzeittest nicht als Mutagen oder Klastogen, und darüber hinaus in Langzeittest an Ratten nicht Karzinogen als erwiesen.[9]
Synthese

Patent
- Patent WO2006116764: Polycyclic carbamoylpyridone derivative having HIV integrase inhibitory activity. Angemeldet am 28. April 2006, veröffentlicht am 2. November 2006, Anmelder: Brian Alvin Johns, Takashi Kawasuji, Teruhiko Taishi, Yoshiyuki Taoda, Erfinder: SmithKline Beecham Corporation; Shionogi & Co., Ltd..
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
In der ersten frühen Nutzenbewertung ging es 2014 um eine Behandlung therapienaiver und antiviral vorbehandelter Erwachsener und Jugendlicher ab 12 Jahren mit Dolutegravir in Kombination mit anderen antiretroviralen Arzneimitteln. Bei den vorbehandelten Erwachsenen wurde zusätzlich danach differenziert, ob eine Behandlung mit einem Integrase-Inhibitor die erste oder eine nachrangige Therapieoption darstellt.[11] Gemäß G-BA-Beschluss gibt es für therapienaive Erwachsene einen Beleg für einen beträchtlichen Zusatznutzen und für vorbehandelte Erwachsene, bei denen eine Behandlung mit einem Integrase-Inhibitor die erste Therapieoption darstellt, einen Hinweis auf einen geringen Zusatznutzen. Für die übrigen drei Patientengruppen ist ein Zusatznutzen gegenüber der jeweiligen zweckmäßigen Vergleichstherapie nicht belegt.[12]
2015 wurde für die Wirkstoffkombination Dolutegravir/Abacavir/Lamivudin dieselbe Einteilung in fünf Patientengruppen vorgenommen.[13] Gemäß G-BA-Beschluss gibt es für therapienaive Erwachsene einen Hinweis auf einen beträchtlichen Zusatznutzen gegenüber Efavirenz in Kombination mit Tenofovirdisoproxil plus Emtricitabin. Für die vier anderen Patientengruppen ist ein Zusatznutzen nicht belegt.[14]
2017 wurde die Evidenz für HIV-infizierte Kinder von 6 bis unter 12 Jahren betrachtet.[15][16] Gemäß G-BA-Besachluss ist ein Zusatznutzen weder für vorbehandelte noch für nicht vorbehandelte Kinder belegt.[17]
Nach ihrer Zulassung wurde 2018 die Kombination Dolutegravir/Rilpivirin zur Behandlung HIV-1-infizierter Erwachsener bewertet, die virologisch supprimiert und seit mindestens sechs Monaten auf einem stabilen antiretroviralen Regime eingestellt sind, kein virologisches Versagen in der Vergangenheit und keine bekannten oder vermuteten Resistenzen gegen Nicht-Nukleosidale Reverse-Transkriptase-Inhibitoren oder Integrase-Inhibitoren aufweisen.[18] Laut G-BA-Beschluss ist für diese Patienten ein Zusatznutzen gegenüber einer individuellen antiretroviralen Therapie in Abhängigkeit von den Vortherapien und ggf. unter Berücksichtigung von Nebenwirkungen nicht belegt.[19]
Nachdem 2019 die Kombination Dolutegravir/Lamivudin zur Behandlung HIV-1-infizierter Erwachsener und Jugendlicher (ab 12 Jahren, Körpergewicht mindestens 40 kg) zugelassen worden war, die keine bekannten oder vermuteten Resistenzen gegenüber der Klasse der Integrase-Inhibitoren oder Lamivudin aufweisen, wurde in einer weiteren frühen Nutzenbewertung erneut zwischen Erwachsenen und Jugendlichen sowie zwischen therapienaiven und antiratroviral vorbehandelten Patienten unterschieden.[20][21][22] Gemäß G-BA-Beschluss ist ein Zusatznutzen dieser Wirkstoffkombination gegenüber der jeweiligen zweckmäßigen Vergleichstherapie für keine der vier Gruppen belegt.[23]
Weblinks
Einzelnachweise
- Patent EP2602260: Verfahren zur Herstellung einer Verbindung mit HIV-Integrase-hemmender Wirkung. Angemeldet am 4. August 2011, veröffentlicht am 28. September 2016, Anmelder: Shionogi & Co., Ltd., Erfinder: Yukihito Sumino, Kazuya Okamoto, Moriyasu Masui, Daisuke Yamada, Fumiya Ikarashi.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- EPAR Triumeq, abgerufen am 6. August 2021.
- Eintrag zu Dolutegravir. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2017.
- Highlights of Prescribing Information Tivicay. (PDF; 332 kB) FDA, August 2014; abgerufen am 4. Juni 2017.
- Gebrauchsinformation Information für Patienten. GlaxoSmithKline, November 2018; abgerufen am 10. April 2019.
- Rebecca Zash, Lewis Holmes, Modiegi Diseko, Denise L. Jacobson, Sean Brummel, Gloria Mayondi, Arielle Isaacson, Sonya Davey, Judith Mabuta, Mompati Mmalane, Tendani Gaolathe, M. Essex, Shahin Lockman, Joseph Makhema, Roger L. Shapiro: Neural-Tube Defects and Antiretroviral Treatment Regimens in Botswana. In: New England Journal of Medicine, 2019, Band 381, Ausgabe 9, 29. August 2019, S. 827–840, doi:10.1056/NEJMoa1905230
- M. L. Cottrell, T. Hadzic, A. D. Kashuba: Clinical pharmacokinetic, pharmacodynamic and drug-interaction profile of the integrase inhibitor dolutegravir. In: Clinical Pharmacokinetics. Band 52, Nummer 11, November 2013, S. 981–994, doi:10.1007/s40262-013-0093-2, PMID 23824675, PMC 3805712 (freier Volltext) (Review).
- Fachinformation Dolutegravir (Tivicay®). (PDF) GlaxoSmithKline Pharmaceuticals S.A., abgerufen am 25. September 2017.
- P. K. Quashie, R. D. Sloan, M. A. Wainberg: Novel therapeutic strategies targeting HIV integrase. In: BMC Medicine, Band 10, April 2012, S. 34, doi:10.1186/1741-7015-10-34, PMID 22498430, PMC 3348091 (freier Volltext) (Review).
- A14-08 Dolutegravir – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A14-34 Dolutegravir/Abacavir/Lamivudin – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Abacavir/Lamivudin (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A17-1 Dolutegravir (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 6. April 2020.
- A17-37 Dolutegravir (HIV-Infektion) – Addendum zum Auftrag A17-11. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir (neues Anwendungsgebiet: HIV-Infektion, 6 bis < 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A18-34 Dolutegravir/Rilpivirin (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Rilpivirin (HIV-Infektion). g-ba.de; abgerufen am 6. April 2020.
- A19-55 Dolutegravir/Lamivudin (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 6. April 2020.
- A19-102 Dolutegravir/Lamivudin (HIV-Infektion) – Addendum zum Auftrag A19-55. iqwig.de; abgerufen am 6. April 2020.
- A19-103 Dolutegravir/Lamivudin (HIV-Infektion) – 2. Addendum zum Auftrag A19-55. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Lamivudin (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.