Bendamustin
Bendamustin ist ein antitumorales Chemotherapeutikum aus der Gruppe der Alkylanzien. Innerhalb der Alkylanzien gehört es, neben Chlorambucil und Melphalan, zur Gruppe der N-Lost- oder auch Stickstoff-Lost-Derivate, die bereits im Ersten Weltkrieg als chemische Kampfstoffe bekannt waren. Haupteinsatzbereich ist die Hämatologie.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
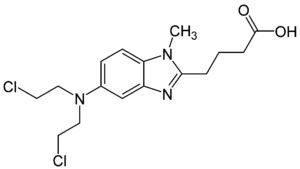 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Bendamustin | |||||||||||||||||||||
| Andere Namen |
4-[5-[Bis(2-chlorethyl)amino]-1-methylbenzimidazol-2-yl]butansäure | |||||||||||||||||||||
| Summenformel | C16H21Cl2N3O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01AA09 | |||||||||||||||||||||
| Wirkstoffklasse |
Zytostatika | |||||||||||||||||||||
| Wirkmechanismus |
Alkylantium | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 358,26 g·mol−1 | |||||||||||||||||||||
| Löslichkeit |
12,5 g·L−1 in Wasser (20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Bendamustin wurde in den 1960er Jahren am Institut für Mikrobiologie und Experimentelle Therapie (IMET) in der DDR entwickelt und 1963 von Werner Ozegowski und Dietrich Krebs beschrieben.[3] Es trug anfänglich die Bezeichnung IMET3393 und kam Ende der 1960er Jahre in der DDR als Cytostasan® in den Verkehr. Nach der Wiedervereinigung wurde es 1993 in der Bundesrepublik zugelassen. Seither gab es mehrere Einschränkungen der arzneimittelrechtlichen Zulassung wegen ungenügender Nachweise für Wirksamkeit und Unbedenklichkeit.[4]
Wirkung und Eigenschaften
Bendamustin ist ein alkylierender Wirkstoff. Er greift auf besondere Art und Weise in die Vermehrung der Krebszellen ein. Dabei verwebt der Wirkstoff sich mit der Tumor-DNA. Dadurch können die Krebszellen sich nicht mehr teilen. Auf diese Weise limitiert Bendamustin das Tumorwachstum.[5]
Kinetik und Metabolisierung
Bendamustin verteilt sich unabhängig vom Alter und vom Tumorstadium schnell in verschiedenste Gewebe (Verteilungshalbwertszeit ca. 7 Minuten). Die Gewebeverteilung ist ungleichmäßig. Die Ausscheidung von Bendamustin erfolgt zu 90 % über die Faeces. Weniger als 10 % werden unverändert im Urin wiedergefunden. Inklusive der Metabolite Monohydroxybendamustin, Dihydroxybendamustin, M 3 und M 4 werden binnen 24 Stunden insgesamt 20 % der verabreichten Dosis im Urin gefunden. Es kann unabhängig von der Nierenfunktion dosiert werden. Wie andere N-Loste wird auch Bendamustin an der Bischlorethylpartialstruktur nicht-enzymatisch zu Mono- und Dihydroxybendamustin hydrolysiert. Die aktive Metabolisierung von Bendamustin findet in der Leber statt. Der Phase-I-Metabolismus läuft über Cytochrom P450 Subtypus 1A2 ab (CYP1A2). Aktive Metaboliten sind das γ-Hydroxybendamustin (M 3) und das N-Desmethylbendamustin (M 4). Die Plasmakonzentration dieser Metaboliten ist 1/10 respektive 1/100 der Muttersubstanz, sodass man davon ausgehen muss, dass dem unveränderten Bendamustin die hauptsächliche zytotoxische Wirkung zukommt (Übersicht[6][7]).
Nebenwirkungen
Nachdem für Bendamustin lange Zeit ein relativ günstiges Nebenwirkungsprofil galt, wurden 2013 Studienergebnisse aus der MAINTAIN-Studie veröffentlicht[8][9] die auf Basis der Auswertung von 947 Patienten aufzeigten, dass es bei der Erstbehandlung indolenter Non-Hodgkin-Lymphome (einschließlich follikulärem Lymphom) in Kombination mit Rituximab bei über der Hälfte der Patienten zum massiven Verlust CD4-positiver Zellen kam. Gleichzeitig kam es gehäuft zu Fällen Progressive multifokale Leukenzephalopathie. 2017 wurde in einem Rote-Hand-Brief nach weiteren Befunden aus klinischen Studien davor gewarnt, dass eine Behandlung mit Bendamustin zur Verlängerung einer Lymphopenie (< 600 Zellen/µl) oder zu niedrigen CD4-positiven T-Zellzahlen (T-Helferzellen) (< 200 Zellen/µl) führen kann, die mindestens 7–9 Monate nach Beendigung der Behandlung andauern und die vor allem auftreten, wenn Bendamustin mit Rituximab kombiniert wird. Patienten mit Lymphopenie und niedrigen CD4-positiven T-Zellzahlen nach der Behandlung mit Bendamustin sind anfälliger für (opportunistische) Infektionen.
Bendamustin in Kombination mit Rituximab war beim Einsatz als Primärtherapie des indolenten Non-Hodgkin-Lymphoms oder Mantelzelllymphoms in der BRIGHT-Studie verglichen zu den Standard-Rituximab-Chemotherapie-Kombinationen Rituximab plus Cyclophosphamid, Doxorubicin, Vincristin und Prednison (CHOP) oder Rituximab plus Cyclophosphamid, Vincristin und Prednison (CVP) mit einer erhöhten Mortalität und einem ungünstigen Sicherheitsprofil assoziiert.
In ähnlicher Weise war in einer klinischen Studie zur Untersuchung der Wirksamkeit und Sicherheit bei bisher unbehandelten follikulären Lymphomen (GALLIUM-Studie) die Kombination von Bendamustin mit Obinutuzumab oder Rituximab mit einer hohen Rate an Todesfällen verbunden.[10] Die Fachgesellschaft deutscher Hämatologen DGHO nahm dazu wie folgt Stellung: „Die meisten dieser Todesfälle waren durch Infektionen bedingt. Dieser Umstand mag auf der unter Bendamustin zu beobachtenden raschen und lang anhaltenden Reduktion von CD3/CD4 Zellen beruhen, die unter CHOP oder COP nicht gesehen wurde.“[11]
Hautkrebs-Risiko unter Bendamustin
Im Dezember 2020 wurde die Fachinformation des Bendamustin-Präparats Levact mit einem Hinweis zu einem erhöhten Risiko von sekundären Krebserkrankungen versehen, die von Hautzellen ausgehen:[12][13] „In klinischen Studien wurde ein erhöhtes Risiko für Nicht-Melanom-Hautkrebs (Basalzellkarzinom und Plattenepithelkarzinom) bei Patienten beobachtet, die mit Bendamustin-haltigen Therapien behandelt wurden. Für alle Patienten werden regelmäßige Hautuntersuchungen empfohlen, insbesondere für solche mit Hautkrebs-Risikofaktoren“. Die Resultate der zugrundeliegenden Prüfung durch die zuständigen Behörden werden in einem Dokument der Europäischen Arzneimittel-Agentur EMA dargestellt[14], das auf einem Prüfbericht des deutschen Bundesinstituts für Arzneimittel und Medizinprodukte BfArM aus dem Jahr 2020 beruht. In diesem Dokument der EMA wird unter anderem auf Ergebnisse der GALLIUM-Studie verwiesen. Demnach wurde in dieser Studie jeweils eine Chemotherapie mit entweder Rituximab oder Obinutuzumab kombiniert, wobei als Chemotherapie entweder Bendamustin, CHOP (Cyclophosphamid, Doxorubicin, Vincristin und Prednison) oder CVP (Cyclophosphamid, Vincristin und Prednison) zum Einsatz kamen. Die genannte Quelle der EMA gibt die in der GALLIUM-Studie gefundene Anzahl der jeweils von Basalzellkarzinomen, Plattenzellkarzinomen oder Morbus Bowen betroffenen Patienten an, woraus sich folgende Häufigkeiten errechnen lassen: 4,9 % der Patienten, die Bendamustin erhalten hatten, waren von einer der genannten Krebsarten betroffen (33 von 676 Patienten), aber nur 0,4 % der Patienten, bei denen CHOP oder CVP eingesetzt wurde (2 von 513 Patienten). In derselben Quelle wird für die BRIGHT-Studie die Häufigkeit von Nicht-Melanom-Hautkrebs mit 6,3 % der Patienten angegeben, die Bendamustin in Kombination mit Rituximab erhalten hatten (14 von 221 Patienten).
Einsatz
Das hauptsächliche Anwendungsgebiet von Bendamustin ist die chronische lymphatische Leukämie. Hier ist Bendamustin das Mittel der Wahl, wenn eine Therapie mit Fludarabin nicht den gewünschten Erfolg bringt oder nicht möglich ist. Des Weiteren stellt Bendamustin als sekundäre Monotherapie eine Option in der Behandlung von indolenten Non-Hodgkin-Lymphomen dar, wenn dieser Lymphdrüsenkrebs trotz Behandlung mit Rituximab weiter wächst. Bei bestimmten Patientengruppen wird Bendamustin mitunter in fortgeschrittenen Stadien von multiplem Myelom (maligne Plasmazellumwandlung im Knochenmark) angewendet.[5]
Zugelassen ist Bendamustin in Deutschland laut Fachinformation[15] für folgende Indikationen:
- Primärtherapie bei chronischer lymphatischer Leukämie (Binet-Stadium B oder C) bei Patienten, bei denen eine Fludarabin-Kombinations-Chemotherapie ungeeignet ist.
- Monotherapie bei indolenten Non-Hodgkin-Lymphomen bei Patienten mit Progression während oder innerhalb von 6 Monaten nach Behandlung mit Rituximab oder mit einer Rituximab-haltigen Therapie (Sekundärtherapie).
- Primärtherapie bei multiplem Myelom (Stadium II nach Durie-Salmon mit Progression oder Stadium III) in Kombination mit Prednison, bei Patienten, die älter als 65 Jahre und nicht für eine autologe Stammzellen-Transplantation geeignet sind und die bereits bei Diagnosestellung eine klinische Neuropathie aufweisen, wodurch eine Behandlung mit Thalidomid oder Bortezomib ausgeschlossen ist.
Unwirksam ist Bendamustin bei Melanomen,[16] Keimzelltumoren,[17] Weichteilsarkomen,[18] Plattenepithelkarzinomen im Kopf-Hals-Bereich,[19] bei hepatozellulären und bei Gallengangskarzinomen.[20]
Fertigarzneimittel
Levact, Generika
Einzelnachweise
- Sicherheitsdatenblatt Ribomustin (Memento vom 18. September 2013 im Internet Archive) (PDF; 115 kB), Stand 1. März 2007.
- Datenblatt Bendamustine hydrochloride hydrate bei Sigma-Aldrich, abgerufen am 30. Oktober 2021 (PDF).
- W. Ozegowski, D. Krebs: ω-[Bis-(β-chloräthyl)-amino-benzimidazolyl-(2)]-propion- bzw. -buttersäuren als potentielle Cytostatika. In: J Prakt Chem. Band 20, Nummer 3–4, 1963, S. 178–186. doi:10.1002/prac.19630200310
- Veröffentlichung. Europäische Arzneimittelagentur (EMA) 2017; abgerufen am 17. Februar 2020
- Bendamustin Anwendung. Gelbe Liste; abgerufen am 17. Februar 2020
- J. Barth, M. Rummel: Bendamustin – antitumorales N-Lost-Derivat mit klinischen Besonderheiten. In: Arzneimitteltherapie. 28, 2010, S. 114–122.
- J. Barth, M. Rummel: Antitumorale Therapie mit Bendamustin. In: Krankenhauspharmazie. 31, 2010, S. 393–404.
- Burchardt et al: Zwischenauswertung MAINTAIN-Studie (Vortrag Nr. 32). 2013, abgerufen am 17. August 2020.
- Burchardt et al.: newevidence.com (PDF) 2013 New Evidence, S. 82; abgerufen am 17. Februar 2020
- Rote-Hand-Brief Levact (Bendamustin) 2017. (PDF) bfarm.de; abgerufen am 17. Februar 2020
- Stellungnahme (PDF; 355 kB) der DGHO zur Nutzenbewertung von Arzneimitteln für seltene Erkrankungen gemäß § 35a SGB V, Obinutuzumab (follikuläres Lymphom, Erstlinientherapie); abgerufen am 17. Februar 2020
- Fachinformation "Levact® 2,5 mg/ml, Pulver für ein Konzentrat zur Herstellung einer Infusionslösung" Stand Dezember 2020
- Wissenschaftliche Schlussfolgerungen. Abgerufen am 26. Februar 2021.
- Europäische Arzneimittelagentur EMA: PRAC PSUR Assessment Report PSUSA/00003162/202001, 04. September 2020. Abgerufen am 2. Februar 2021.
- Fachinformation Bendamustin. (PDF; 76 kB) amazonaws.com; abgerufen am 17. Februar 2020
- M. Schmidt-Hieber, A. Schmittel u. a.: A phase II study of bendamustine chemotherapy as second-line treatment in metastatic uveal melanoma. In: Melanoma Research. Band 14, Nummer 6, Dezember 2004, S. 439–442. PMID 15577312.
- C. Kollmannsberger, A. Gerl u. a.: Phase II study of bendamustine in patients with relapsed or cisplatin-refractory germ cell cancer. In: Anti-Cancer Drugs. Band 11, Nummer 7, August 2000, S. 535–539. PMID 11036955.
- J. T. Hartmann, F. Mayer u. a.: Bendamustine hydrochloride in patients with refractory soft tissue sarcoma: a noncomparative multicenter phase 2 study of the German sarcoma group (AIO-001). In: Cancer. Band 110, Nummer 4, August 2007, S. 861–866, doi:10.1002/cncr.22846. PMID 17599772.
- D. Bottke, K. Bathe u. a.: Phase I trial of radiochemotherapy with bendamustine in patients with recurrent squamous cell carcinoma of the head and neck. In: Strahlentherapie und Onkologie. Band 183, Nummer 3, März 2007, S. 128–132, doi:10.1007/s00066-007-1597-1. PMID 17340070.
- K. Schoppmeyer, F. Kreth u. a.: A pilot study of bendamustine in advanced bile duct cancer. In: Anti-Cancer Drugs. Band 18, Nummer 6, Juli 2007, S. 697–702, doi:10.1097/CAD.0b013e32803d36e6. PMID 17762399.