Obinutuzumab
Obinutuzumab (alte Bezeichnung Afutuzumab, Handelsname Gazyvaro® oder außerhalb der EU als Gazyva®; Hersteller Roche) ist ein humanisierter monoklonaler Antikörper, der zur Therapie einer therapieresistenten Chronisch Lymphatischen Leukämie (CLL) und/oder eines follikulären Lymphoms (FL), dem häufigsten Typ des indolenten (langsam wachsenden) Non-Hodgkin-Lymphoms (NHL), eingesetzt werden kann.
| Obinutuzumab | ||
|---|---|---|
| ||
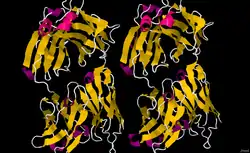
| Zwei identische Dimere des GA101-Fab-Fragments (Mus musculus) als Bändermodell, nach PDB 3PP3 | ||
|
Vorhandene Strukturdaten: 3PP3 | ||
| Masse/Länge Primärstruktur | 146 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L01XC15 | |
| Wirkstoffklasse | Zytostatikum, monoklonaler Antikörper | |
Wirkungsweise
GA101 (Obinutuzumab) wirkt ähnlich wie Rituximab und Ofatumumab als CD20-Antikörper. Dieser Wirkstoff ist der erste monoklonale CD20-Antikörper der 2. Generation, der mit der Technik des sogenannten Glykoengineering (Glykosylierung) optimiert wurde. Dadurch kann die Vernichtung bösartiger B-Lymphozyten durch Aktivierung anderer Immunzellen gegen Krebszellen oder die direkte Auslösung des Zelltodes verbessert werden.
Zulassungsstatus
In den USA erfolgte – wegen der zu erwartenden guten Ergebnisse – ein beschleunigtes Zulassungsverfahren. Im November 2013 wurde Gazyva® in Kombination mit Chlorambucil von der FDA zur Behandlung einer vormals unbehandelten CLL zugelassen.[1] Im Juli 2014 wurde Gazyvaro® in der EU zur Behandlung von Patienten mit einer vormals unbehandelten CLL zugelassen.[2] Für Europa empfahl das CHMP der europäischen Zulassungsbehörde EMA im April 2016 die Zulassung in der Indikation FL.[3] Im September 2017 erteilte die Europäische Kommission eine Zulassung für die Erstlinienbehandlung von Patienten mit follikulärem Lymphom.[4]
Studien
Eine deutsche Studie mit 781 Patienten zeigte, dass Obinutuzumab im Vergleich zu Rituximab bessere Ergebnisse bei der Behandlung komorbider Patienten mit CLL erzielt.[5] Im Schnitt konnte die progressionsfreie Überlebenszeit um 10 Monate verlängert werden, indem bei der Standardtherapie Rituximab und Chlorambucil ersteres durch Obinutuzumab ersetzt wurde. Es kam unter Obinutuzumab aber häufiger zu Infusionsreaktionen und Neutropenien.
Historie
Entwickelt wurde GA-101 durch Glycart Biotechnology AG, Genentech, Hoffmann-La Roche, Biogen Idec und Chugai Pharmaceutical.[6][2]
Dosierung
In der Phase-III-Studie CLL11 der Deutschen CLL-Studiengruppe wurde Obinutuzumab mit Chlorambucil kombiniert. Die Patienten erhielten 1000 mg Obinutuzumab intravenös an den Tagen 1, 8 und 15 (Zyklus 1) und Tag 1 (Zyklus 2–6), was einer möglichen Dosierung laut Fachinformation entspricht, sowie 0,5 mg Chlorambucil/kg Körpergewicht oral an den Tagen 1 und 15 jedes Zyklus.[7][8]
Siehe auch
- Nomenklatur der monoklonalen Antikörper: Konvention zur Benennung von monoklonalen Antikörpern
Weblinks
- American Society of Hematology (ASH), Stand 12/2010
- Deutsche CLL Studiengruppe
Einzelnachweise
- FDA approves Gazyva for chronic lymphocytic leukemia. FDA, Pressemitteilung, 1. November 2013; abgerufen am 30. Juli 2014
- Roche’s Gazyvaro approved in Europe for patients with the most common type of leukemia (Memento des Originals vom 2. August 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Roche, Pressemitteilung, 29. Juli 2014; abgerufen am 30. Juli 2014
- CHMP empfiehlt EU-Zulassung für Gazyvaro von Roche für Patienten mit vorbehandeltem follikulärem Lymphom. Roche, Pressemitteilung, 29. April 2016; abgerufen am 1. Mai 2016
- Gazyvaro zur First-line Behandlung von follikulärem Lymphom zugelassen. In: Gelbe Liste Online. Abgerufen am 1. April 2021.
- Valentin Goede, Kirsten Fischer, Raymonde Busch, Anja Engelke, Barbara Eichhorst, Clemens Wendtner, Tatiana Chagorova, Javier de la Serna, Marie-Sarah Dilhuydy, Thomas Illmer, Stephen Opat, Carolyn J. Owen, Olga Samoylova, Karl-Anton Kreuzer, Stephan Stilgenbauer, Hartmut Döhner, Anton W. Langerak, Matthias Ritgen, Michael Kneba, Elina Asikanius, Kathryn Humphrey, Michael Wenger, Michael Hallek: Obinutuzumab plus Chlorambucil in Patients with CLL and Coexisting Conditions. In: New England Journal of Medicine. 2014, 370: 1101–1110, doi:10.1056/NEJMoa1313984.
- GA-101, a third-generation, humanized and glyco-engineered anti-CD20 mAb for the treatment of B-cell lymphoid malignancies. Researchgate, abgerufen am 9. Juli 2014 (englisch).
- Deutsche CLL-Studiengruppe: CLL11 Studie. (dcllsg.de [abgerufen am 2. Juni 2021]).
- European Medicines Agency: Gazyvaro 1.000 mg Konzentrat zur Herstellung einer Infusionslösung, Zusammenfassung der Merkmale des Arzneimittels. (europa.eu [PDF; abgerufen am 2. Juni 2021]).