Babesiose des Hundes
Die Babesiose des Hundes (Synonym „Hundemalaria“, Piroplasmose) ist eine durch Einzeller der Gattung Babesia hervorgerufene Infektionskrankheit bei Hunden, die eine Zerstörung der roten Blutkörperchen und damit eine mehr oder weniger ausgeprägte Blutarmut (Anämie) hervorruft. Die Erkrankung verläuft meistens akut mit hohem Fieber und endet ohne Behandlung binnen weniger Tage tödlich. Die Übertragung erfolgt durch Zecken. Während die Babesiose bis in die 1970er Jahre vor allem eine „Reisekrankheit“ war, kommt sie durch die Ausdehnung des Verbreitungsgebiets der Auwaldzecke mittlerweile auch nördlich der Alpen natürlich vor. Die Diagnose wird über einen Nachweis der Babesien-DNA oder eine mikroskopische Untersuchung des Blutes gesichert. Zur Behandlung werden Antiprotozoika eingesetzt.

Andere Tierarten oder der Mensch sind durch die beim Hund krankheitsauslösenden Babesien nicht gefährdet. Allerdings kommen auch bei anderen Säugetieren Erkrankungen durch zumeist wirtsspezifische Babesien vor (→ Babesiose des Menschen und Systematik der Babesien).
Erreger und Verbreitung
Babesien sind Einzeller, die als Parasiten die roten Blutkörperchen befallen. Sie werden den Apicomplexa zugeordnet. Ein Abschnitt ihres Vermehrungszyklus findet im Zwischenwirt – verschiedenen Zeckenarten – statt. Die Babesiose der Hunde wird durch mehrere Babesienarten hervorgerufen, die für andere Tierarten nicht krankheitserregend sind. In einer Studie ließen sich zwar Antikörper gegen Babesia canis bei Pferden nachweisen, die Infektion verläuft bei diesen Tieren aber ohne klinische Symptome und ist selbstlimitierend.[1] Mittlerweile sind 9 genetisch unterscheidbare Babesien-Arten beim Hund bekannt.[2]
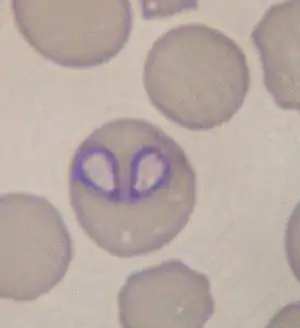
Babesia canis (Piana & Galli-Valerio, 1895) ist eine relative große Babesienart (2–4 × 4–7 μm), die weltweit vorkommt. Man unterscheidet heute drei Unterarten, die sich hinsichtlich ihrer DNA und ihres Vektors, aber nicht morphologisch unterscheiden:
- Babesia canis canis wird durch die Auwaldzecke (Dermacentor reticularis) übertragen, die sich mittlerweile in ganz Mitteleuropa ausgebreitet hat.[3] Diese Babesien-Unterart ist im deutschsprachigen Raum am häufigsten für Erkrankungen bei Hunden verantwortlich. Ursprünglich nur in Nordafrika, Nord- und Mittelitalien, Frankreich und im südlichen Teil Ungarns und Österreichs vorkommend („Mittelmeerkrankheit“), gibt es mittlerweile Naturherde in Deutschland, der Schweiz, Holland und Polen. Der Erreger ist stark krankheitsauslösend. Man unterscheidet zwei Stämme. Der Frankreich-Stamm kommt aus dem nördlichen und östlichen Mittelmeerraum und kommt mittlerweile auch in einigen südwestlichen Regionen Deutschlands vor. Der Ungarn-Stamm kommt vor allem auf dem Balkan und in der Ukraine vor, mittlerweile aber auch in einigen Regionen Ostdeutschlands.
- Babesia canis vogeli wird durch die Braune Hundezecke (Rhipicephalus sanguineus) übertragen. Infektionen mit diesem Erreger sind in Mitteleuropa selten und verlaufen mild. Verbreitet ist B. c. vogeli in Nordafrika, dem Mittelmeerraum und Frankreich.
- Babesia canis rossi wird durch Haemaphysalis elliptica verbreitet und kommt nur in Afrika südlich der Sahara vor. Der Erreger ist die am stärksten krankheitsauslösende Babesienart.[4]
In neueren Arbeiten werden diese drei großen Babesien auch als separate Arten gezählt, zudem gibt es zwei weitere Isolate (North-Carolina-Isolat und Großbritannien-Isolat), die auf weitere große Babesienarten hinweisen.[5]
Babesia gibsoni (Patton, 1910) ist eine weitere bei Hunden vorkommende Babesienart. Sie ist kleiner (1,1–2 × 1,2–4 μm) und damit auch morphologisch von B. canis zu unterscheiden. Der Erreger ist vor allem in Asien und den Vereinigten Staaten[6] verbreitet, man unterscheidet einen Asia- und einen California-Genotyp. Überträger sind Zecken der Gattungen Haemaphysalis (Haemaphysalis spinosa) und Rhipicephalus.[7] Im Jahre 2007 wurden erstmals zwei ortsständige Infektionen mit dem asiatischen Genotyp in Deutschland beschrieben.[8] In einer aktuellen Studie wird vorgeschlagen, die „kleinen Babesien“ des California-Genotyps als eigenständige Art, Babesia conradae, einzustufen.[9] Die ebenfalls zu den „kleinen Babesien“ gezählte Art Babesia vulpes (früher Theileria annae), befällt primär Füchse und kommt im Bereich der Pyrenäen und in Nordamerika vor. Ihr Überträger ist wahrscheinlich die Igelzecke (Ixodes hexagonus).[10]
Der erste Nachweis der Erkrankung wurde 1934 in den USA erbracht. Es gab aber bereits Berichte über Hundeerkrankungen in Afrika aus dem Jahr 1896, die auf eine Babesiose hinweisen.[5] Das ursprüngliche Verbreitungsgebiet der Babesiose (Enzootiegebiet) innerhalb Europas beschränkte sich bis in die 1970er Jahre auf Südeuropa, so dass die Erkrankung in Deutschland nahezu ausschließlich bei Hunden nach Urlaubsreisen in diese Region auftrat. Mit der Ausbreitung der Auwaldzecke auf ganz Mitteleuropa kommen ortsständige Krankheitsfälle auch in Deutschland vor: Etwa ein Drittel der erkrankten Hunde hatte niemals einen Auslandsaufenthalt. Die Durchseuchung der Auwaldzecken mit Babesien ist in Deutschland zwar noch relativ gering, allerdings stetig ansteigend. Etwa 0,5 % der Auwaldzecken sind Babesienträger.[11] Nachdem zunächst nur am Oberrhein ortsständige Infektionen beobachtet wurden, gibt es mittlerweile Enzootiegebiete im Saarland, in Rheinland-Pfalz, in den Isarauen bei München, in der Umgebung von Regensburg, in den Elbauen und in Brandenburg. Derzeit werden einige tausend Erkrankungen pro Jahr in Deutschland festgestellt.[12] Davon sind etwa 300–400 ortsständige Infektionen, die fast alle im Saarland und am Oberrhein auftreten.[11]
Krankheitsentstehung
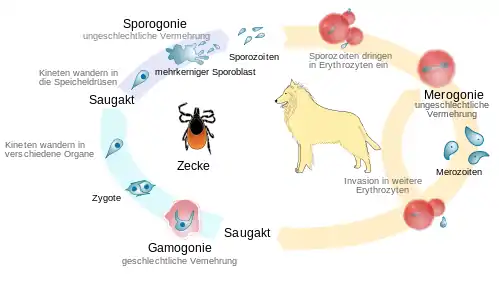
Die Übertragung beim Zeckenstich dauert etwa 48 bis 72 Stunden, unter experimentellen Bedingungen konnte bereits nach 12 Stunden nach Anheften der Zecke eine Übertragung von B. c. canis nachgewiesen werden. Durch das Anheften der Zecke an den Wirt werden durch Reizung des Nervensystems die in verschiedenen Organen ruhenden Sporozoiten aktiviert und entwickeln sich zu Kineten, die dann in die Speicheldrüsen einwandern und mit dem Zeckenspeichel in den Blutkreislauf des Hundes gelangen. Neben der Übertragung durch Zecken ist eine Infektion von Hund zu Hund über eine Bluttransfusion oder durch Blut-Blut-Kontakte – beispielsweise bei Beißereien – möglich. Auch eine Übertragung von der Hündin auf ihre Nachkommen („vertikale Infektion“) wird vermutet und ist für B. gibsoni nachgewiesen.[13]
Die Sporozoiten dringen in die roten Blutkörperchen (Erythrozyten) der Hunde ein und vollziehen eine ungeschlechtliche Vermehrungsphase (Merogonie). Die dabei entstehenden Entwicklungsstadien (sogenannte Merozoiten) führen zu einer Schädigung der Erythrozyten, werden nach deren Zerstörung freigesetzt und können dann wiederum in neue, noch nicht befallene Erythrozyten eindringen. Der Organismus zeigt als Reaktion auf die Infektion zunächst eine Akute-Phase-Reaktion mit Anstieg des C-reaktiven Proteins und Fibrinogens, einem Thrombozyten- und Leukozytenabfall sowie einer Senkung des Blutdrucks.[14] Im weiteren Verlauf kommt es zu einer Immunantwort mit Bildung von IgG- und IgM-Antikörpern. Eine vollständige Beseitigung des Erregers durch das Immunsystem des Hundes findet jedoch nicht statt, so dass diese Tiere eine ständige Infektionsquelle (Erregerreservoir) darstellen und damit für die Aufrechterhaltung des Infektionszyklus sorgen.
Zecken nehmen bei einem Saugakt die befallenen Erythrozyten auf. Im Zeckendarm entwickeln sich die Merozoiten zu geschlechtlichen Babesienstadien (Gamonten und Gameten). Diese differenzieren sich zu Kineten, welche in die Eier innerhalb der Eierstöcke der Zecke eindringen und somit den Erreger auf die Zeckennachkommen weitergeben (transovarielle Übertragung). Durch diese transovarielle Übertragung sind nicht nur adulte Zecken, sondern auch Nymphen Babesienüberträger. Zudem wandern die Kineten in die Speicheldrüsen der Zecke, wo sie sich zu den für Hunde infektiösen Sporozoiten differenzieren.
Krankheitsbild
In Deutschland tritt vor allem die akut verlaufende Form der Babesia-canis-canis-Infektion auf. Die Inkubationszeit beträgt 5 bis 7 Tage, selten kann sie bis zu drei Wochen nach dem Zeckenstich dauern. Krankheitszeichen (Symptome) sind ein gestörtes Allgemeinbefinden und Fieber, gefolgt von Fressunlust, Gewichtsverlust und Abgeschlagenheit. Ein bis zwei Tage später kommt es aufgrund des Zerfalls der roten Blutkörperchen (Hämolyse) zu Blutarmut (Anämie), Blutharnen, Ausscheidung des Blutfarbstoffabbauprodukts Bilirubin über den Harn (Bilirubinurie) und gegebenenfalls auch Gelbsucht. Eine Leber- und Milzvergrößerung kommt häufig vor. Bei schweren Verläufen treten eine Bauchwassersucht und Wasseransammlungen (Ödeme) sowie Haut- und Schleimhautblutungen infolge Blutplättchenmangel (Thrombozytopenie) und eine Blutgerinnung innerhalb der Blutgefäße (disseminierte intravasale Koagulopathie) auf. Entzündungen der Maul- (Stomatitis) und Magenschleimhaut (Gastritis) sowie der Muskulatur (Myositis) sind häufig. Auch eine zentralnervöse Form mit epilepsieähnlichen Anfällen, Bewegungsstörungen und Lähmungen ist möglich. Die akute Form endet unbehandelt binnen weniger Tage mit dem Tod durch Atemnot, Anämie und Nierenversagen, welches eine gefürchtete Komplikation einer Babesiose ist. Der seltene perakute Verlauf endet ohne deutliche Symptome binnen ein bis zwei Tagen tödlich. Die Infektion mit B. canis rossi verläuft ähnlich wie die mit B. canis canis.[15]
Der Grad der klinischen Erscheinungen hängt von verschiedenen Faktoren ab. In den klassischen Naturherden von Babesia canis canis (Südösterreich, Ungarn, Norditalien) sind die Jungtiere aufgrund einer hohen Durchseuchung im Allgemeinen durch Antikörper aus der Erstmilch (Kolostrum) der Hündin geschützt, entwickeln durch primäre Latenz einen weitgehenden Schutz und werden zu immunen Überträgern. Hier dominiert der chronische oder subklinische Krankheitsverlauf mit unspezifischen Symptomen wie intermittierendem Fieber, Fressunlust, Blutarmut und allgemeiner Schwäche.[16] Auch die Infektionen mit B. canis vogeli und den „kleinen Babesien“ verlaufen milder.
Diagnostik
Die Babesiose kann klinisch mit einer Vielzahl anderer fieberhafter Erkrankungen verwechselt werden. Die Diagnose ist über einen normalen Blutausstrich („Dünner Tropfen“) oder den so genannten „Dicken Tropfen“ möglich, wobei Kapillarblut sensitiver ist als venöses Blut.[15] Die Erreger können in der Frühphase der Infektion und in den Phasen zwischen den Vermehrungsschüben im Blut (Parasitämie) nur in geringer Zahl auftreten und damit übersehen werden. Sicher ist der Nachweis im Blutausstrich erst etwa sieben Tage nach der Infektion. Die Babesien können unter dem Mikroskop nachgewiesen werden, wobei die Giemsa-Färbung – im Gegensatz zu den üblichen Schnellfärbungen – am zuverlässigsten ist. B. canis zeigt sich als paarweise oder in größeren Gruppen rosettenförmig angeordnete birnenförmige Gebilde in den roten Blutkörperchen, B. gibsoni als ringförmig angeordnete Strukturen. Ein sicherer PCR-Nachweis der DNA der Erreger ist bereits 3 bis 5 Tage nach der Infektion möglich.
Serologische Untersuchungen wie der Immunfluoreszenzantikörpertest und der Enzyme-linked Immunosorbent Assay (ELISA) sind bei akutem Verlauf ohne Bedeutung, da die Tiere noch keine Antikörper gebildet haben. Antikörper sind frühestens 10 Tage nach der Infektion nachweisbar. Bei chronischem Verlauf treten zyklische Veränderungen des Antikörperspiegels auf.
Sind bei einer Blutuntersuchung die Leukozytenzahl < 7250/µl, die Thrombozytenzahl < 55.000/µl und die Retikulozytenzahl < 61.600/µl ist bei entsprechendem Vorbericht immer an eine Babesiose zu denken, so dass ein direkter Erregernachweis versucht werden sollte. Differentialdiagnostisch müssen vor allem eine Anaplasmose, eine immunbedingte hämolytische Anämie, eine immunbedingte Thrombozytopenie, eine Infektion mit Mycoplasma haemocanis, Entzündungen des Harntraktes und Vergiftungen mit Zwiebeln ausgeschlossen werden.[4]
Behandlung und Vorbeugung
Da die Krankheit bei nicht aus Endemiegebieten stammenden Tieren und Babesienarten mit hoher Virulenz ohne Behandlung schnell tödlich endet, sollte bei Verdacht unverzüglich eine Therapie eingeleitet werden. Antiprotozoika wie Imidocarb oder Diminazen sind gegen B. canis gut, gegen „kleine Babesien“ dagegen nur wenig wirksam. Imidocarb kann auch zur Prophylaxe bei Reisen in Endemiegebiete einmalig verabreicht werden – der Schutz hält etwa drei Wochen an. Eine Kombination aus Atovaquon und Azithromycin kann auch chronische Infektionen mit B. gibsoni heilen.[17] Auch Phenamidin ist gegen „kleine Babesien“ wirksam, aber derzeit in Deutschland nicht erhältlich. In akuten Fällen ist bei einem Hämatokrit unter 20 eine Bluttransfusion oder die Gabe von Hämoglobin-Glutamer 200[18] angezeigt. Die Behandlung mit Imidocarb wird je nach Region unterschiedlich gehandhabt. In den ursprünglichen Endemiegebieten wird es mit niedriger Dosierung einmalig angewendet, um die akute Erkrankung zu unterdrücken, aber den Erreger zur Ausbildung einer langen belastbaren Immunität nicht vollständig zu eliminieren. In nicht-endemischen Regionen wird der Wirkstoff dagegen in höherer Dosierung zweimalig angewendet. Dadurch wird der Erreger vollständig bekämpft, die anschließende Immunität hält dafür aber nur 1 bis 2 Jahre.[19] Zur Behandlung seropositiver Hunde ohne Krankheitsanzeichen gibt es bislang keine validen Richtlinien. Nach gegenwärtigem Kenntnisstand ist eine Behandlung solcher Hunde nicht angezeigt, wenn die PCR negativ ist. Bei Tieren mit entfernter Milz oder immunsupprimierten Tieren sollte dennoch eine Behandlung in Erwägung gezogen werden.[2]
Die wichtigste Prophylaxe ist das Absuchen des Tieres nach Zecken nach jedem Spaziergang und deren sofortige Entfernung. Ein Schutz vor Zecken durch äußerlich anzuwendende zeckenabtötende Wirkstoffe (Akarizide wie Deltamethrin, Flumethrin oder Permethrin) oder oraler Akarizide wie Fluralaner oder Afoxolaner ist sinnvoll, da sie auch die Gefahr des Auftretens weiterer, durch Zecken auf Hunde übertragbarer Erkrankungen wie Borreliose, Ehrlichiose, Hepatozoonose oder FSME senken.
Gegen B. c. canis und B. c. rossi existiert ein Impfstoff (Handelsname Nobivac Piro), der zwar nicht vor einer Infektion schützt, aber die Erkrankung deutlich abmildert. Der Impfstoff ist trotz EU-weiter Zulassung in Deutschland nicht erhältlich, in der Schweiz, Österreich und Frankreich jedoch verfügbar. Er muss nach einer zweimaligen Grundimmunisierung halbjährlich verabreicht werden und sollte nicht zusammen mit anderen Impfungen und nicht an bereits infizierte Tiere verabreicht werden. Als Nebenwirkungen werden vor allem Schwellungen an der Injektionsstelle, Fieber, Abgeschlagenheit und steifer Gang beobachtet, die von allein abklingen.[20] Die Ständige Impfkommission Veterinärmedizin empfiehlt einen generellen Einsatz derzeit nicht und rechnet sie zu den nicht unbedingt notwendigen (non-core) Impfungen.[21]
Literatur
- Dieter Barutzki et al.: Die Babesiose des Hundes. In: Deutsches Tierärzteblatt. 55, 2007, ISSN 0340-1898, S. 284–293.
- Katrin Hartmann: Parasitäre Infektionen. In: Peter F. Suter und Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul-Parey-Verlag, Stuttgart 2006, ISBN 3-8304-4141-X, S. 316–324.
- Cornelia Heile und Eberhard Schein (Hrsg.): Leitlinie Verhinderung der Erregerübertragung durch blutsaugende Vektoren bei Hunden. Bundesverband Praktizierender Tierärzte, 2007.
- Maja Hirsch: Babesiose. In: Reisekrankheiten in Europa. IDEXX Laboratories 2009, S. 2–5.
Einzelnachweise
- S. Hornok et al.: Serological evidence for Babesia canis infection of horses and an endemic focus of B. caballi in Hungary. In: Acta Vet Hung. 55 (2007), S. 491–500. PMID 18277708
- Nikola Pantchev und Maja Hirsch: Vektorübertragene Infektionen des Hundes („CBVD“) in Europa. Idexx, 4. Auflage.
- Hans Dautel et al.: Evidence for an increased geographical distribution of Dermacentor reticulatus in Germany and detection of Rickettsia sp. RpA4. In: International Journal of Medical Microbiology 296 (2006), Supplement 1, S. 149–156. PMID 16524777
- Barbara Hinney und Michael Leschnik: Reiseparasitosen der Hunde und Katzen. In: Kleintierpraxis. Band 60, Nr. 5, 2015, S. 254–282.
- Nico Pantchev: Zeckenübertragene Reiseinfektionen beim Hund: Ehrlichiose und Babesiose. In: Veterinärspiegel 4 (2012), S. 162–170.
- A.J. Birkenheuer: Geographic distribution of babesiosis among dogs in the United States and association with dog bites: 150 cases (2000–2003). In: J Am Vet Med Assoc. 227 (2005), S. 942–947. PMID 16190594
- A. Matsuu et al.: Incidence of canine Babesia gibsoni infection and subclinical infection among Tosa dogs in Aomori Prefecture, Japan. In: J Vet Med Sci. 66 (2004), S. 893–897. PMID 15353837
- K. Hartelt et al.: First evidence of Babesia gibsoni (Asian genotype) in dogs in Western Europe. Vector Borne Zoonotic Dis. 2007 Summer;7(2):163-166. PMID 17627433
- A.M. Kjemtrup et al.: Babesia conradae, sp. Nov., a small canine Babesia identified in California. Vet Parasitol. 2006 May 31;138(1-2):103-111. PMID 16524663
- Gad Baneth,corresponding author Monica Florin-Christensen, Luís Cardoso, and Leonhard Schnittger: Reclassification of Theileria annae as Babesia vulpes sp. nov. In: Parasit Vectors. 207 (2015); 8 PMC 4393874 (freier Volltext)
- T. J. Naucke: Babesiose/Piroplasmose – ein Update. In: Veterinärspiegel 1 (2008), S. 14–14.
- Hundemalaria in 2008 wieder auf dem Vormarsch
- S. Fukumoto et al.: Fatal experimental transplacental Babesia gibsoni infections in dogs. Int J Parasitol. 35 (2005), S. 1031–1035. PMID 15979628
- T. P. Schetters et al.: Systemic inflammatory responses in dogs experimentally infected with Babesia canis; a haematological study. In: Vet Parasitol. 162 (2009), S. 7–15. PMID 19269099
- M. Böhm et al.: Capillary and venous Babesia canis rossi parasitaemias and their association with outcome of infection and circulatory compromise. In: Vet Parasitol. 141(2006), S. 18–29. PMID 16806713
- L. Solano-Gallego et al.: Babesia canis canis and Babesia canis vogeli clinicopathological findings and DNA detection by means of PCR-RFLP in blood from Italian dogs suspected of tick-borne disease. In: Veterinary Parasitology 157 (2008), S. 211–221. PMID 18789581
- H.J. Vial und A. Gorenflot: Chemotherapy against babesiosis. In: Vet Parasitol. 138 (2006), S. 147–160. PMID 16504402
- A. B. Zambelli und A. L. Leisewitz: A prospective, randomized comparison of Oxyglobin (HB-200) and packed red blood cell transfusion for canine babesiosis. In: Journal of Veterinary Emergency and Critical Care 19 (2009), S. 102–112.
- Laboklin aktuell 03/2016
- vetpharm.uzh.ch
- Impfempfehlungen der Ständigen Impfkommission des bpt (PDF; 590 kB)