Canine Anaplasmose
Die Canine Anaplasmose ist eine durch Zecken übertragene Infektionskrankheit des Hundes, die durch Bakterien der Gattung Anaplasma hervorgerufen wird. Sie gehört damit zu den Vektor-basierten Hundekrankheiten. Die durch Anaplasma phagocytophilum hervorgerufene Erkrankung wurde früher auch als „Granulozytäre Ehrlichiose“ bezeichnet. A. phagocytophilum befällt auch andere Säugetiere und den Menschen (→ Humane Granulozytäre Anaplasmose), bei der Erkrankung handelt es sich also um eine Zoonose. Allerdings kommen die (seltenen) Infektionen des Menschen durch diesen Erreger nur durch Ansteckung über Zecken zustande, eine Hund-Mensch-Übertragung ist unwahrscheinlich, theoretisch aber bei direktem Blutkontakt möglich.[1]
In den meisten Fällen verläuft die Infektion beim Hund stumm, es treten also keine Krankheitssymptome auf. Stark krankheitsauslösende Stämme des Erregers können aber auch schwere Verlaufsformen verursachen. Typische Symptome sind Fieber, punktförmige Blutungen und Nasenbluten. Die Behandlung erfolgt meist mit Doxycyclin.
Erreger und Vorkommen

Anaplasmen sind Gram-negative Proteobakterien aus der Ordnung der Rickettsiales. Der Erreger der Caninen Anaplasmose ist Anaplasma phagocytophilum. Es handelt sich um ein ausschließlich innerhalb von Zellen lebende (obligat intrazelluläre) Bakterium, das eine Untergruppe der weißen Blutkörperchen, die Granulozyten, befällt. Da der Erreger früher zur Gattung Ehrlichia gerechnet wurde, wird die Erkrankung in der älteren Literatur als „Granulozytäre Ehrlichiose“ bezeichnet.
Außer für den Hund ist A. phagocytophilum auch für andere Säugetiere einschließlich des Menschen krankheitsauslösend. Als Überträger (Vektor) fungiert vor allem der Gemeine Holzbock (Ixodes ricinus), eine in Europa weit verbreitete Zeckenart. In Nordeuropa spielt auch die Taigazecke (Ixodes persulcatus) eine Rolle, in Nordamerika wird der Erreger durch die Hirschzecke (Ixodes scapularis) verbreitet.[2] Die Infektion mit A. phagocytophilum kommt in ganz Nord- und Mitteleuropa vor und ist auch in Deutschland häufig, im Gegensatz zu der nur im Mittelmeerraum auftretenden Caninen Ehrlichiose.[3] Die Übertragung des Erregers erfolgt während des Saugakts nach 24 bis 48 Stunden.[4]
Die Erkrankung wurde in der Vergangenheit vor allem in der Schweiz beobachtet („Schweizerische Ehrlichiose“). Neuere Untersuchungen zeigten auch in Deutschland ein relativ häufiges Auftreten. Die Seroprävalenz bei Hunden in Deutschland schwankte in aktuellen Studien zwischen 19 und 50 %[3] und wie in der Schweiz ist etwa ein Prozent der Holzböcke Träger des Erregers.[5] Nach gegenwärtigem Kenntnisstand kommt es nach überstandener Erkrankung oder erfolgreicher Behandlung nicht zu einer Erregerelimination, das heißt, einmal infizierte Tiere bleiben lebenslang Träger des Erregers.[1]
Eine zweite für Hunde krankheitsauslösende Anaplasmen-Art ist Anaplasma platys. Sie stammt eigentlich aus Amerika, mittlerweile gibt es aber Naturherde im äußersten Süden Europas. A. platys wird von der Braunen Hundezecke übertragen und verursacht die Canine Cyclische Thrombozytopenie.
Symptome
Die Inkubationszeit beträgt 2 bis 20 Tage. Die Folgen einer Infektion sind sehr unterschiedlich, die Mehrzahl der Hunde zeigt jedoch keinerlei Symptome. Abhängig von der krankheitsauslösenden Potenz des Erregerstammes und der Abwehrkraft des Tieres können aber auch schwere Krankheitsbilder auftreten.[1]
Eine klinisch manifeste Erkrankung durch Anaplasma phagocytophilum verläuft meist mit Abgeschlagenheit, Fieber und Fressunlust. Typisch ist eine Abnahme der Blutplättchen (Thrombozytopenie) mit Neigung zu Blutungen, die in 80 % der Fälle auftritt. Sehr häufig werden daher Nasenbluten, punktförmigen Blutungen der Schleimhäute und Organblutungen beobachtet. Die durch die Organblutungen ausgelösten Entzündungsreaktionen können je nach betroffenem Organsystem zu Husten, vermehrtem Trinken, Magen-Darm-Symptomen und neurologischen Störungen wie Anfälle, Ataxie und propriozeptive Defizite führen.[1]
Zudem können Muskelverhärtungen, Polyarthritis mit Gelenkschmerz, Gelenkschwellungen und Lahmheit sowie Gewichtsverlust auftreten. Bei einer gleichzeitigen Infektion mit Borrelien (→ Borreliose), welche ebenfalls vom Holzbock übertragen werden, sind die Krankheitszeichen meist stärker ausgeprägt.[6]
Im Blutbild lassen sich neben der Thrombozytopenie häufig eine Abnahme der ebenfalls zu den weißen Blutkörperchen gehörenden Lymphozyten (Lymphopenie), eine Blutarmut ohne ausreichende Blutneubildung, aber mit normalen Blutfarbstoffgehalt (nichtregenerative normochrome Anämie), ein Mangel des Bluteiweißes Albumin (Hypalbuminämie), ein Anstieg der Abwehreiweiße im Blut (Hyperglobulinämie) sowie eine Erhöhung der alkalischen Phosphatase und des C-reaktiven Proteins nachweisen.[6]
Diagnostik
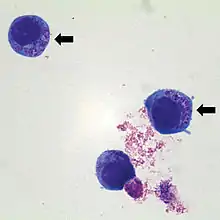
Der Nachweis von 2–5 µm großen, maulbeerartigen Einschlüssen („Morulae“) innerhalb der Neutrophilen Granulozyten im gefärbten Blutausstrich stellt ein einfaches Verfahren zum Erregernachweis dar. Diese „Morulae“ entstehen durch Vermehrung der Bakterien innerhalb von Vakuolen des Cytoplasmas, wodurch sogenannte Elementarkörperchen entstehen, die sich zu Einschlusskörperchen zusammenlagern.[7] Allerdings ist nur ein positiver Nachweis beweisend, da einige Erkrankungen ohne Morulabildung verlaufen.[1] Zudem existiert ein Schnelltest zum Nachweis eines Oberflächenproteins (p44/MSP2), mit dem gleichzeitig auch das C6-Peptid von Borrelia burgdorferi sensu lato und damit eine Koinfektion mit Borrelien nachgewiesen werden kann.[6]
Etwa 10 bis 14 Tage nach der Infektion bzw. zwei bis fünf Tage nach dem Erscheinen von Morulae lassen sich Antikörper gegen A. phagocytophilum mittels indirektem Immunofluoreszenztest (IFAT) nachweisen. Die Titer steigen in den ersten zwei bis drei Wochen an und können nach sieben Monaten wieder unter die Nachweisgrenze fallen.[6] Problematisch ist, dass etwa 40 % der Hunde zum Zeitpunkt der Erkrankung noch seronegativ sind und aufgrund der langen Persistenz der Antikörper muss ein akuter Krankheitsfall auch nicht mit der A.-phagocytophilum-Infektion in Zusammenhang stehen.[3] Zur Diagnostik einer akuten Anaplasmose ist der Antikörpernachweis daher nicht geeignet.[1]
Mittels Polymerase-Kettenreaktion (PCR) ist ein direkter Nachweis der DNA des Erregers und auch eine Differenzierung zwischen A. phagocytophilum und A. platys möglich, zwischen denen in den serologischen Tests eine Kreuzreaktivität besteht. Ein PCR-Nachweis ist bereits etwa eine Woche vor Erscheinen der Morulae möglich.[6] Der PCR-Nachweis im Blut ist ab dem zweiten Tag nach der Infektion bis zu einem Zeitraum von drei bis sechs Wochen möglich. Trotz der vermuteten Erregerpersistenz ist dieser Nachweis daher zum Nachweis einer akuten Infektion geeignet. Da viele Hunde eine stumme Infektion durchmachen, ist eine positive PCR allerdings kein Beweis, dass die vorliegende Erkrankung auch wirklich eine Anaplasmose ist.[1]
Da keines der Verfahren eine sichere Diagnosestellung erlaubt, müssen drei Hauptkriterien für eine definitive Diagnose erfüllt sein:[1]
- positiver direkter Erregernachweis (PCR oder Morulae)
- Thrombozytopenie
- Anstieg der Thrombozytenzahl bei Behandlung mit Doxycyclin innerhalb von wenigen Tagen
Behandlung und Vorbeugung
Die Therapie erfolgt durch Antibiotika wie Doxycyclin, Tetracyclin und Oxytetracyclin über zwei bis vier Wochen. Die Behandlung sollte nur bei Vorliegen klinischer Symptome, also nicht bei stummer Infektion vorgenommen werden. Zur Therapiekontrolle sollte die Thrombozytenzahl überwacht werden. Eine vorbeugende Impfung existiert nicht. Durch regelmäßige Kontrolle und sofortige Entfernung von Zecken bzw. durch den Einsatz von zeckenabwehrenden Wirkstoffen (z. B. Permethrin oder Deltamethrin) kann eine Infektion aber verhindert werden.[1]
Literatur
- Peter F. Suter: Ehrlichiosen, Anaplasmosen, Neorickettsiosen (Rickettsiales-Infektionen, Hunderickettsiosen, canine rickettsiosis). In: Peter F. Suter und Barbara Kohn (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul Parey, Hamburg 2006, ISBN 978-3-8304-4141-0, S. 299–302.
Einzelnachweise
- Michèle Bergmann und Katrin Hartmann: Anaplasmose beim Hund – Infektion häufig, Krankheit selten. In: kleintier konkret. Band 18, Nr. 5, 2015, S. 3–7, doi:10.1055/s-0035-1558509.
- Rolf Bauerfeind: Zoonosen: von Tier zu Mensch übertragbare Infektionskrankheiten. Deutscher Ärzteverlag, Köln 2013, ISBN 978-3-7691-1293-1, S. 213.
- Barbara Kohn: Anaplasma phagozytophilum: Neue Untersuchungen zur Prävalenz, Klinik und Prophylaxe. In: Kleintiermedizin. Nr. 3/4, 2010, S. 98–106.
- Stefan Pachnicke: Vektorprophylaxe: Indirekte Reduktion des Übertragungsrisikos für CVBD-Erreger. In: Der Praktische Tierarzt. Band 97, Nr. 5, 2016, S. 468–469.
- D. Schaarschmidt-Kiener und W. Müller: Labordiagnostische und klinische Aspekte der kaninen Anaplasmose und Ehrlichiose. In: Tierärtl. Praxis. Band 35, 2007, S. 129–136.
- Nikola Pantschev: Canine granulozytäre Anaplasmose beim Hund - Teil 2: Diagnostik, Therapie und Prophylaxe. In: Tierärztl. Journal. Band 2, 2010, S. 132–133.
- Rolf Bauerfeind: Zoonosen: von Tier zu Mensch übertragbare Infektionskrankheiten. Deutscher Ärzteverlag, Köln 2013, ISBN 978-3-7691-1293-1, S. 211.