Membranfusion
Die Membranfusion (Neurophysiologie) bezeichnet einen biochemischen Vorgang in neuronalen Zellen, bei dem die synaptischen Vesikel, welche für die Erregungsweiterleitung mit Neurotransmittern gefüllt sind, über Exocytose an der präsynaptischen Membran abgeschnürt und die Transmittermoleküle (z. B. Acetylcholin, γ-Aminobuttersäure) in den synaptischen Spalt freigesetzt werden, von wo aus sie anschließend das Signal an die nachgeschaltete Zielzelle (z. B. Drüsenzellen, Muskelzellen, Nervenzellen) weiterleiten.
Grundlagen
Cytoskelett
Das Cytoskelett ist ein Netzwerk aus zahlreichen Proteinen, die den intrazellulären Raum aller eukaryotischer Zellen auskleiden und für einige Stoffwechsel- und Transportvorgänge innerhalb der Zelle zuständig sind. Auch die Zellteilung, u. a. bestehend aus Mitose und Cytokinese, wird durch bestimmte Proteinfasern des Cytoskeletts induziert.
Die das Cytoskelett ausmachenden Proteine lassen sich in fünf verschiedene Kategorien unterteilen: Brückenproteine, Begrenzungsproteine, Regelproteine, Motorproteine und Gerüstproteine. Die beiden Letzteren spielen bei der Membranfusion eine grundlegende Rolle.
Das Proteingerüst der Zelle wird durch mehrere Komponenten gebildet. Zum einen durch den aus Tubulin bestehenden Mikrotubulus und zum anderen durch die aus Aktin bestehenden Mikrofilamente. Mikrotubulus und Mikrofilamente einer Zelle werden als Mikrofibrillen zusammengefasst. Da sich die Membranfusion allerdings auf Nervenzellen bezieht, sprechen wir vom Neurotubuli und von Neurofilamenten, die als Neurofibrillen zusammengefasst werden.[1] Als Gerüstproteine zählen sie zur Klasse der Cytoskelettproteine.
Während die die aus Aktin bestehenden Neurofilamente (ca. 10 nm breit) primär die Festigkeit der Zelle unterstützen, kommen dem Neurotubulus (ca. 25 nm breit und innen hohl) schon weitere Aufgaben zu, wie beispielsweise der axonale Transport sowohl in anterograde als auch in retrograde Richtung.
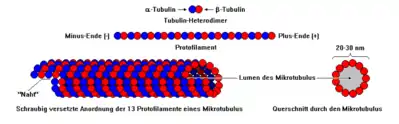
Organisation des Mikrotubulus
Mikrotubuli sind röhrenförmige Proteinfasern, die einen Teil des Cytoskeletts darstellen. Zwei grundlegende Tubulin-Moleküle setzten den Mikrotubulus zusammen und sorgen für negative und positive Ladungen an der Oberfläche des Mikrotubulus. Dabei nimmt das α-Tubulin mit seiner negativen Ladung das eine Ende (siehe Minus-Ende) und das β-Tubulin mit seiner positiven Ladung das andere Ende (siehe Plus-Ende) eines sogenannten Protofilaments ein. Mehrere dieser Protofilamente langen sich anschließend zum Mikrotubulus zusammen.
Der Mikrotubulus besitzt eine spezifische Richtung, hervorgerufen durch die Verankerung des Minuspols im Mikrotubulus-Organisierenden Zentrum (kurz: MTOC für microtubule organizing center), welches zum Beispiel von Zentriolen gebildet werden kann. Da sich in adulten Nervenzellen jedoch keine Zentriolen befinden, was den Verlust der Teilungsfähigkeit zur Folge hat, ist das MTOC in diesem Zelltyp anders organisiert. Der Pluspol endet in Nervenzellen demnach weiter distal, also vom Zellkörper (Perikaryon) entfernt, verläuft durch das Axon und mündet schließlich in den synaptischen Endkolben.
Axonaler Transport
Im Folgenden sei der axonale Transport auf synaptische Vesikel bezogen, die im Zellkörper, dem Perikaryion, synthetisiert werden. Verpackt werden die Transmittermoleküle anschließend durch den Golgi-Apparat, sodass die Vesikel nun bereit für den Transport in den synaptischen Endkolben sind. Dieser Neurotubuli-abhängige Transport wird auch als schneller axonaler Transport (50–400 mm pro Tag) zusammengefasst, von dem der langsame axonale Transport (0,2–5 mm pro Tag) unterschieden wird. Allerdings spielt der langsame axonale Transport bei der Membranfusion eine eher vernachlässigbare Rolle.
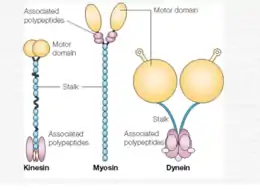
Abhängig vom jeweiligen Motorprotein erfolgt der Neurotubuli-abhängige Transport entweder in anterograde (zur Synapse) oder in retrograde (zum Perikaryon) Richtung. Die dafür verantwortlichen Motorproteine, die eine Kategorie der Cytoskelettproteine bilden, sind unter anderem Kinesin, Dynein und Myosin. Dabei besitzen diese Motorproteine alle einen typischen Aufbau. Die Motordomäne dockt an den Neurotubuli an und sorgt für die Fortbewegung entlang der Proteinfasern, während die Schwanzdomäne die synaptischen Vesikel, Transmittermoleküle enthaltend, bindet und mit sich zieht. Die Fortbewegung liegt den verschiedenen Ladungen der Tubulinmoleküle zugrunde. Da Dynein für den retrograde Transport zuständig ist, eignen sich Kinesin und Myosin für den axonalen Transport der Vesikel in den synaptischen Endkolben. Dennoch gibt es einen Unterschied: Kinesin bindet tatsächlich an den Neurotubulus und transportiert Vesikel und Zellorganelle, während Myosin an die Aktinfilamente des Cytoskeletts bindet, aber ebenfalls Vesikel transportiert und in der Lage ist, diese zu verschieben und die Exocytose (und andere Kontraktionen) zu induzieren.
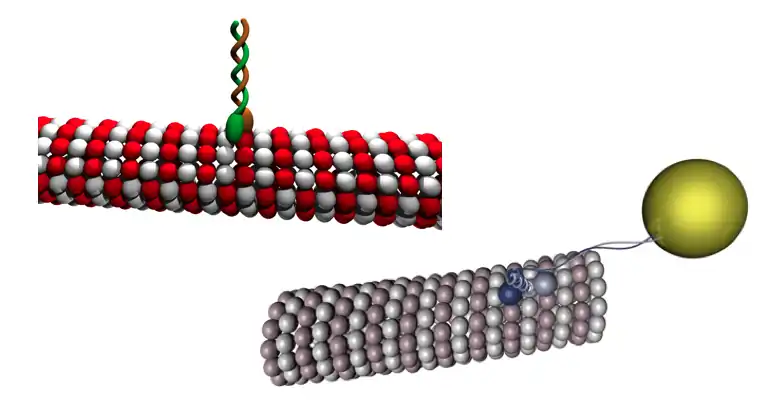
Nach der Bildung der Vesikel am Golgi-Apparat binden diese an die Motorproteine Kinesin und Myosin, welche die Vesikel anschließend in den synaptischen Endkolben transportieren. Dort angekommen lösen sich die Vesikel wieder von den Motorproteinen und binden sich über andere Membranproteine an weitere Proteinfasern im Endkolben, sodass die synaptischen Vesikel für die Membranfusion zur Verfügung stehen.
Synaptische Vesikel
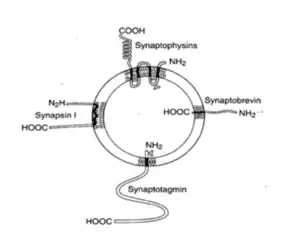
Synaptische Vesikel[2], also jene vom Golgi-Apparat gebildeten Vesikel, die Transmittermoleküle für die Signaltransduktion an der Synapse enthalten, besitzen einen typischen Feinaufbau. Dabei spielen sogenannte SNARE-Proteine (engl. Abkürzung: soluble N-ethylmaleimide-sensitive-factor attachment receptor) eine fundamentale Rolle. An der Membran der Vesikel befinden sich nämlich zahlreiche Membranproteine, wie Synaptobrevine, Synaptotagmine und Synaptophysine. Sie katalysieren den Transport der Vesikel und die Exocytose an der präsynaptischen Membran.[3]
Doch zunächst sind die Vesikel über Synapsine, dünne Membranproteine, mit den Proteinfasern des Cytoskeletts verbunden, die den synaptischen Endkolben durchziehen. Diese Synapsine sorgen dafür, dass sich die Vesikel nicht willkürlich durch die Exocytose abschnüren und Neurotransmitter freisetzten.[4]
Die SNARE-Proteine besitzen dabei den typischen Aufbau eines Peptids. Der N-Terminal mit der Aminogruppe () ist dabei im Körper durch die Anlagerung eines H-Atoms der Carboxygruppe des C-Terminals positiv geladen (), während die Carboxygruppe () am C-Terminal ein H-Atom abspaltet und folglich eine negative Ladung annimmt (). Die negativen und positiven Teilladungen spielen später bei der Membranfusion eine wichtige Rolle (siehe Zwitterion).
Membranfusion
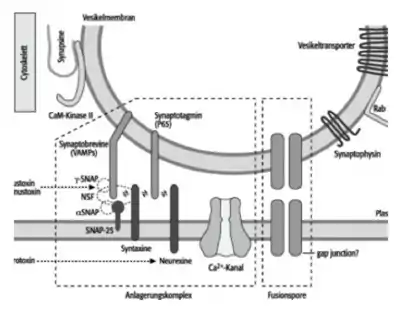
Erreicht ein Aktionspotential als Folge der Erregungsweiterleitung über das Axon den synaptischen Endkolben, werden Neurotransmitter in den synaptischen Spalt ausgeschüttet, die an der Zielzelle (Effektor) eine exzitatorische oder inhibitorische Wirkung zeigen. Die Ausschüttung der Transmittermoleküle, beziehungsweise das Abschnüren der Vesikel an der präsynaptischen Membran wird also durch ein Aktionspotential induziert, welches spannungsabhängige -Kanäle öffnet, was einen Einstrom an Calcium-Ionen zur Folge hat. Durch die zunehmende Konzentration an Calcium-Ionen werden bestimmte Enzyme aktiviert, darunter die Calmodulin-abhängige-Proteinkinase II.[5] Dieses Enzym phosphoryliert die Synapsine, welche die synaptischen Vesikel mit den Proteinfasern des Cytoskeletts verbinden. Durch die Phosphorylierung werden genau diese Bindungen aufgelockert und die Vesikel lösen sich gänzlich von den Proteinfasern.[6]
Wie oben schon beschrieben, ist das Motorprotein Myosin in der Lage, Vesikel anterograd zu transportieren und die Exocytose zu induzieren. Durch die Freigabe der Vesikel von den Proteinfasern, stehen diese nun dem weiteren Transport in Richtung präsynaptischer Membran zur Verfügung. An die Schwanzdomäne des Myosins gebunden, werden die Vesikel weiter transportiert, bis sie schließlich über die Exocytose abgeschnürt werden.
An der präsynaptischen Membran befinden sich ebenfalls bestimmte Membranproteine, sogenannte Neurexine und Syntaxine. Durch die oben genannten verschiedenen Teilladungen der Proteine am N- und C-Terminal wechselwirken die Membranproteine der Vesikel mit den Rezeptorproteinen der präsynaptischen Membran. SNARE-Komplexe lagern sich zusammen und die Exocytose kann vonstattengehen: Die Vesikel werden abgeschnürt und die Transmitter freigesetzt.
Wirkung von Nervengiften
Bestimmte Nervengifte sind in der Lage, in die Signalübertragung der Nervenzellen einzugreifen und die Membranfusion zu behindern. Eines der bekanntesten Neurotoxinen, das dazu in der Lage ist, ist Botulinumtoxin (BTX)[7], welches mehrere neurotoxische Proteine umfasst, die von Stämmen des Bakteriums Clostridium botulinum ausgeschieden werden. Im menschlichen Körper verhindert es die Ausschüttung von Transmittermolekülen. Die Folgen sind Atemlähmung und Herzstillstand. Verhindert wird das Abschnüren der Vesikel dadurch, dass bestimmte Typen des BTX, darunter die Typen B, D, F und G, Proteinkomplexe an der Vesikelmembran spalten, unter ihnen das SNARE-Protein Synaptobrevin. Der Typ C hingegen zerstört das Rezeptorprotein Syntaxin. Da diese Proteine die Grundlage der Membranfusion bilden, kann diese nun nicht mehr stattfinden.
Siehe auch
Literatur
- Martin Trepel: Neuroanatomie – Struktur und Funktion. 6. Auflage. Elsevier/Urban & Fischer, München 2015, ISBN 978-3-437-41287-5.
- Michael Schuler, Werner Waldmann (Hrsg.): Gesundheitsaltlas Anatomie. Der menschliche Körper und seine Funktionen in über 600 Abbildungen. Naumann & Göbel Verlag, Köln 2009, ISBN 978-3-625-12654-6.
Weblinks
Einzelnachweise
- Neurotubuli - Lexikon der Biologie. (spektrum.de [abgerufen am 20. Oktober 2017]).
- synaptische Vesikel - Lexikon der Biologie. (spektrum.de [abgerufen am 20. Oktober 2017]).
- SNARE - Lexikon der Biologie. (spektrum.de [abgerufen am 20. Oktober 2017]).
- Synapsine - Lexikon der Neurowissenschaft. (spektrum.de [abgerufen am 20. Oktober 2017]).
- Calcium-Calmodulin-abhängige Proteinkinase II - Lexikon der Neurowissenschaft. (spektrum.de [abgerufen am 20. Oktober 2017]).
- Membranfusion - Lexikon der Biologie. (spektrum.de [abgerufen am 20. Oktober 2017]).
- DocCheck Medical Services GmbH: Botulinumtoxin - DocCheck Flexikon. Abgerufen am 20. Oktober 2017.