Atropisomerie
Atropisomerie ist ein Spezialfall der axialen Chiralität. Bei Atropisomeren handelt es sich um Rotamere, bei denen die Rotation um eine kovalente Einfachbindung durch sterisch anspruchsvolle Substituenten derart eingeschränkt ist, dass Konformere isoliert werden können. Nach einer Definition von M. Oki muss die Halbwertszeit der Isomerisierung (Umwandlung des einen Rotamers in das andere) bei einer gegebenen Temperatur länger als 1000 Sekunden sein.[1]
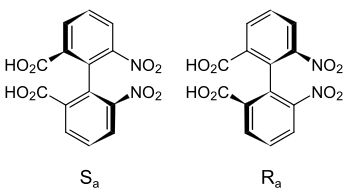
Erstmals beschrieben wurde das Phänomen „Atropisomerie“ 1922 von Christie und Kenner, die die Isomere von 6,6′-Dinitro-2,2′-diphensäure trennen konnten.[2] Atropisomerie kann auch bei sterisch anspruchsvoll α-substituierten Styrolen beobachtet werden. Enthalten solche Atropisomere noch ein zusätzliches Chiralitätszentrum, so können diastereomere Atropisomere einfach NMR-spektroskopisch nachgewiesen werden.
Stereochemie und Nomenklatur
Atropisomere sind Enantiomere, die sich trennen lassen und – wie andere Enantiomere – gewöhnlich gleiche chemische und physikalische Eigenschaften haben, mit Ausnahme des Drehwertes. In chiraler Umgebung, d. h. bei einer chemischen Reaktion mit einem Enantiomer einer anderen chiralen Verbindung, zeigen Atropisomere – wie andere Enantiomere – unterschiedliche Eigenschaften und Wirkungen. So sind auch die physiologischen Eigenschaften von Atropisomeren in der Regel verschieden. Hinsichtlich der Nomenklatur werden die Regeln des Cahn-Ingold-Prelog-Systems angewandt und die Konfiguration der chiralen Achse als Ra bzw. Sa beschrieben oder entsprechend der Helix-Nomenklatur mit den Deskriptoren P (Plus) bzw. M (Minus) die Stereochemie beschrieben.
Beispiele
Ein Anwendungsfeld der Atropisomerie ist die asymmetrische Synthese. Chirale Auxiliare wie BINAP oder BINOL werden in stereoselektiven Reaktionen eingesetzt.
Atropisomere Produkte finden sich bei einzelnen Arzneistoffen, Naturstoffen und bei dem Herbizid Metolachlor.[3]
Der Arzneistoff Telenzepin enthält eine C–N-Bindung, die aufgrund blockierter Drehbarkeit stereogen ist. In neutraler wässriger Lösung beträgt die Halbwertzeit zur Racemisierung etwa 1000 Jahre. Nach Enantiomerentrennung zeigte sich, dass das (+)-Isomer auf den Muskarinrezeptor M1 eine etwa 500-fach stärkere Hemmwirkung hat als das (−)-Isomer.[4]
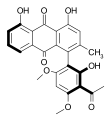 Knipholon
Knipholon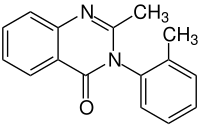
 Telenzepin
Telenzepin
Weblinks
- PDF bei www.vanderbilt.edu (343 kB)
- PDF bei www.scs.illinois.edu (2,3 MB)
- 3D-Visualisierungen Biphenyl, 1-Phenyl-naphthalin
- 3D-Visualisierungen Styrol, 1-Methylstyrol
- 3D-Visualisierung Benzophenon, 2-Methylbenzophenon
- 3D-Visualisierung Bisphenol A
- 3D-Visualisierung Typ Triphenylmethanfarbstoffe
- 3D-Visualisierungen BINAP, BINOL, Metolachlor
Einzelnachweise
- M. Oki: Recent Advances in Atropisomerism. in "Topics in Stereochemistry", 1983, Vol. 14, S. 1–81.
- Christian Wolf: Dynamic stereochemistry of chiral compounds: principles and applications. The Royal Society of Chemistry, Cambridge 2008 (eingeschränkte Vorschau in der Google-Buchsuche), S. 84.
- H. U. Blaser: The Chiral Switch of (S)-Metolachlor: A Personal Account of an Industrial Odyssey in Asymmetric Catalysis, Advanced Synthesis & Catalysis 2002, 344, 17-31. doi:10.1002/1615-4169(200201)344:1<17::AID-ADSC17>3.0.CO;2-8.
- J. Clayden, W. J. Moran, P. J. Edwards, S. R. LaPante: The Challenge of Atropisomerism in Drug Discovery, Angew. Chem. Int. Ed. 2009, 48, 6398–6401.