Valsartan
Valsartan ist ein Arzneistoff aus der Gruppe der AT1-Antagonisten, der in der Behandlung von Bluthochdruck und leichter bis mittelschwerer Herzinsuffizienz, falls eine ACE-Hemmer-Therapie ungeeignet ist, eingesetzt wird. Valsartan wurde 1991 von Ciba-Geigy AG – heute Novartis – patentiert.[2]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
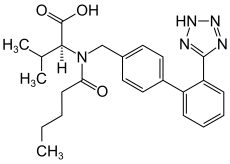 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Valsartan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H29N5O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer hygroskopischer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 435,52 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Juli 2018 wurde eine vermutlich krebserregende Verunreinigung von Chargen eines chinesischen Wirkstoffherstellers bekannt und betroffene Fertigarzneimittel in Europa und Nordamerika vom Markt genommen.
Klinische Angaben
Anwendungsgebiete
Valsartan wird für die Behandlung folgender Krankheiten eingesetzt:
- Behandlung der essentiellen Hypertonie leichten und mäßigen Grades.
- Valsartan ist zugelassen für die Therapie von milder bis mittelschwerer Herzinsuffizienz (NYHA II und III) üblicherweise in Komedikation mit einem Diuretikum und Digitalis, wenn eine Behandlung mit ACE-Hemmern infolge von unerwünschten Wirkungen (trockener Husten) ungeeignet ist. Nebenwirkungen anlässlich einer Therapie mit ACE-Hemmern, die durch eine allgemeine Beeinflussung auf das Renin-Angiotensin-Aldosteron-System entstehen (zum Beispiel eine progredient verlaufende Niereninsuffizienz, Hyperkaliämie (Serumkaliumwert über 5,0 mmol/l)), stellen keine Indikation für Valsartan dar.
Status nach akutem Myokardinfarkt
- Langzeitprophylaxe bei Patienten mit stabilem Status nach Myokardinfarkt verbunden mit einer linksventrikulären Dysfunktion mit einer Auswurffraktion ≤ 40 %.[4]
Gegenanzeigen
Überempfindlichkeit gegenüber Valsartan. Hereditäres Angioödem; Angioödem in der Anamnese unter Therapie mit einem ACE-Hemmer oder Angiotensin-II-Rezeptorantagonisten; Niereninsuffizienz (Kreatinin-Clearance < 10 ml/min): keine Erfahrung; Es liegen keine Therapieerfahrungen mit Valsartan bei Kindern und Jugendlichen (unterhalb von 18 Jahren) vor.
Studien
Die 2001 veröffentlichte Val-HeFT-Studie (Valsartan heart failure trial) mit 5010 Patienten ergab bei Patienten mit Herzinsuffizienz mit NYHA-Stadium II bis IV eine verringerte Hospitalisierungsrate. Bei den anderen Endpunkten der Studie (kardiopulmonale Reanimation, Gesamtsterblichkeit u. a.) gab es keinen Unterschied von Valsartan plus Standardtherapie versus Standardtherapie plus Placebo. Patienten ohne Betablocker und ACE-Hemmer profitierten vom Valsartan. Die Kombination von ACE-Hemmer, Betablocker und Valsartan zeigte sich eher ungünstig.[5][6]
Anwendung während Schwangerschaft und Stillzeit
- Schwangerschaft
Es gibt mit Valsartan keine Erfahrungen bei schwangeren Frauen. Präklinische Studien mit Tierversuchen zeigten mit Valsartan jedoch fetale und neonatale Schäden mit Todesfällen, welche auf die Wirkungen des Arzneistoffs im Renin-Angiotensin-Aldosteron-System (RAAS) zurückgeführt werden. Arzneistoffe, die direkt auf das RAAS wirken, können Schäden in der fetalen Entwicklung verursachen, wenn sie während der Schwangerschaft im zweiten und dritten Trimenon angewendet werden. Die fetale Nierenperfusion beginnt beim Menschen, welche von der Entwicklung des Renin-Angiotensin-Aldosteron-Systems abhängig ist, im zweiten Trimenon. Demnach erhöht sich das Risiko bei einer Therapie mit Valsartan-haltigen Arzneimitteln im zweiten und dritten Trimenon. Im ersten Trimenon wird die Anwendung von Valsartan nicht empfohlen, sondern es ist die Umstellung auf ein Mittel Therapie mit geeignetem Sicherheitsprofil vorzuziehen. Im zweiten und dritten Trimenon ist Valsartan kontraindiziert.[7]
- Stillzeit
Es ist nicht bekannt, ob Valsartan in die Muttermilch übertritt. Bei der Ratte wurden demgegenüber bedeutsame Spiegel von Valsartan und seinem aktiven Metaboliten in der Milch gefunden. Daher ist eine alternative blutdrucksenkende Therapie mit einem besseren Sicherheitsprofil bei Anwendung in der Stillzeit vorzuziehen, insbesondere wenn Neugeborene oder Frühgeburten gestillt werden.[7]
Valsartan bei Niereninsuffizienz
Da der Qo-Wert von Valsartan hoch ist (Qo = 0,7), ist keine Dosisanpassung bei eingeschränkter Nierenfunktion notwendig. Bei vielen Arzneimitteln mit hohem Qo-Wert entstehen renal eliminierte Metaboliten, deren Aktivität nicht immer bekannt ist. Entsprechend ist bei schweren Einschränkungen der Nierenfunktion grundsätzlich Vorsicht geboten.[8][9]
Pharmakologische Eigenschaften
Wirkungsmechanismus
Das Valsartan wirkt als AT1-Antagonist direkt am Angiotensinrezeptor. Damit soll im Vergleich zu den ACE-Hemmern der durch Bradykinin ausgelöste Reizhusten seltener auftreten.[10]
Pharmakokinetik
Es werden nach heutigen Erkenntnissen keine aktiven Metaboliten des Valsartan gebildet, die Ausscheidung erfolgt zu 30 % über die Nieren. Die restlichen 70 % werden über die Leber verstoffwechselt. Die Bioverfügbarkeit ist im Gegensatz zu Losartan geringer und beträgt etwa 23–25 %. Die Bioverfügbarkeit verringert sich durch Nahrungsaufnahme stärker als bei Losartan und Eprosartan, die Einnahme bei gleichzeitiger Nahrungsaufnahme senkt den Plasmaspiegel um 48 %. Der maximale Plasmaspiegel wird nach 2 Stunden erreicht. Die biologische Halbwertszeit von Valsartan liegt bei 6–9 Stunden.[11][12]
Krebserregende Verunreinigungen
Im Juli 2018 wurde die Verunreinigung bestimmter Chargen eines chinesischen Wirkstoffherstellers mit einer als krebserregend geltenden Substanz aufgedeckt. Betroffene Fertigarzneimittel wurden in Europa und Nordamerika vom Markt genommen. In der Folge wurden sowohl Verunreinigungen in Valsartan weiterer Wirkstoffhersteller festgestellt als auch in anderen Arzneistoffen aus der Gruppe der Sartane (Irbesartan, Losartan).
Relevanz für die Trinkwasserversorgung
Im Jahr 2013 wurden im Trinkwasser der Stadt Berlin Rückstände des mikrobiellen Transformationsproduktes Valsartansäure nachgewiesen.[13] Aufgrund der strukturellen Ähnlichkeit wird angenommen, dass Valsartansäure auch aus weiteren Wirkstoffen aus der Gruppe der Sartane, wie bspw. Candesartan, Losartan, Irbesartan und Olmesartan, gebildet werden kann.[13][14] Seit 2015 liegt eine Risikobewertung des Umweltbundesamtes vor. Demnach beträgt der Gesundheitliche Orientierungswert (GOW) für Valsartansäure im Trinkwasser 0,3 µg/L.[15] Es stehen End-of-pipe-Technologien zur Reduzierung der in den Wasserkreislauf abgegebenen Arzneimittelfracht zur Verfügung, bspw. Ozonung oder die Anwendung von Aktivkohle in der Abwasserbehandlung bzw. bei der Trinkwasseraufbereitung. Diese Verfahren sind jedoch kosten- und energieintensiv und widersprechen dem Verursacherprinzip sowie Artikel 7 Absatz 3 der Europäischen Wasserrahmenrichtlinie (EU-WRRL), der einen nachhaltigen Gewässerschutz mit dem Ziel, den für die Gewinnung von Trinkwasser erforderlichen Umfang der Aufbereitung zu verringern, vorsieht.[16] Eine Anpassung der Verordnungspraxis durch die behandelnden Ärzte stellt eine Möglichkeit dar, den Eintrag von Valsartansäure-Vorläuferverbindungen in die Umwelt zu minimieren.[17]
Handelsnamen
Angiosan (A), Cordinate (D), Diovan (protect/forte) (D, A, CH), Provas (D), Valsacor (D, A), Valsartan (A), zahlreiche Generika (D)
- mit Hydrochlorothiazid: Co-Angiosan (A), CoDiovan (forte) (D, A, CH), Cordinate plus/ -forte (D), Provas comp/ -maxx (D), Cotareg (forte), zahlreiche Generika (D)
- mit Amlodipin: Copalia (A), Dafiro (A), Exforge (D, A, CH), Imprida (A)
- mit Amlodipin und Hydrochlorothiazid: Dafiro HCT[18][19][20]
- mit Sacubitril: Entresto
Weblinks
- Welche Tragweite könnten die Valsartan-Rückrufe haben? DAZ online am 5. Juli 2018.
- Valsartan: chargenbezogener Rückruf valsartanhaltiger Arzneimittel, deren Wirkstoff von dem chinesischen Hersteller Zhejiang Huahai Pharmaceutical produziert wurde. Mitteilung des Bundesinstituts für Arzneimittel und Medizinprodukte, Stand: 11. Juli 2018
Einzelnachweise
- Datenblatt VALSARTAN FOR SYSTEM SUITABILITY CRS (PDF) beim EDQM, abgerufen am 26. Juli 2009.
- Eintrag zu Valsartan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Datenblatt Valsartan ≥98% bei Sigma-Aldrich, abgerufen am 17. August 2016 (PDF).
- Fachinformation Diovan® von Novartis-Pharma.
- T. Stefenelli: AT1-Rezeptorblocker nach Val-HeFT. In: Journal für Kardiologie. 9 (7-8), 2002, S. 332–334. (PDF-Datei; 577 kB) .
- arznei telegramm 2002: Herzinsuffizienz: Valsartan kann Mortalität erhöhen.
- Diovan Fachinformation, Novartis Pharma GmbH, Stand März 2014.
- Dosisanpassung bei Niereninsuffizienz bei Dosing (Memento vom 27. September 2007 im Internet Archive).
- G. Flesch, P. Muller, P. Lloyd: Absolute bioavailability and pharmacokinetics of valsartan, an angiotensin II receptor antagonist. In: Eur J Clin Pharmacol. 52, 1997, S. 115–120, doi:10.1007/s002280050259.
- Björn Lemmer, Kay Brune (Hrsg.): Pharmakotherapie. 14. Auflage. Springer, Heidelberg 2010, ISBN 978-3-642-10540-1, S. 232 f.
- Hasso Scholz, Ulrich Schwabe (Hrsg.): Taschenbuch der Arzneibehandlung: angewandte Pharmakologie. 13., überarb. und aktualisierte Auflage. Springer, Berlin / Heidelberg 2005, ISBN 978-3-540-20821-1, S. 431; 878.
- Björn Lemmer, Kay Brune (Hrsg.): Pharmakotherapie. 14. Auflage. Springer, Heidelberg 2010, ISBN 978-3-642-10540-1, S. 207.
- Karsten Nödler, Olav Hillebrand, Krzysztof Idzik, Martin Strathmann, Ferry Schiperski: Occurrence and fate of the angiotensin II receptor antagonist transformation product valsartan acid in the water cycle – A comparative study with selected β-blockers and the persistent anthropogenic wastewater indicators carbamazepine and acesulfame. In: Water Research. Band 47, Nr. 17, 1. November 2013, ISSN 0043-1354, S. 6650–6659, doi:10.1016/j.watres.2013.08.034.
- Susanne Kern, Rebekka Baumgartner, Damian E. Helbling, Juliane Hollender, Heinz Singer: A tiered procedure for assessing the formation of biotransformation products of pharmaceuticals and biocides during activated sludge treatment. In: Journal of Environmental Monitoring. Band 12, Nr. 11, 3. November 2010, ISSN 1464-0333, S. 2100–2111, doi:10.1039/C0EM00238K.
- Jonas Stoll: Gesundheitlicher Orientierungswert - GOW. 25. Mai 2020, abgerufen am 28. Januar 2021.
- Richtlinie 2000/60/EG des Europäischen Parlaments und des Rates vom 23. Oktober 2000 zur Schaffung eines Ordnungsrahmens für Maßnahmen der Gemeinschaft im Bereich der Wasserpolitik. OJ L, 32000L0060, 22. Dezember 2000 (europa.eu [abgerufen am 28. Januar 2021]).
- am 12 Oktober 2017: Auswirkungen der Verordnungspraxis von Antihypertonika auf die Trinkwasserqualität in Deutschland am Beispiel Berlins. Abgerufen am 28. Januar 2021.
- Rote Liste Online, Stand: August 2009.
- Arzneimittelkompendium der Schweiz, Stand: August 2009.
- AGES-PharmMed, Stand: August 2009.