Sulfamid
Sulfamid ist als das Diamid der Schwefelsäure sowohl eine chemische Verbindung aus der Gruppe der Amide als auch eine Sulfurylverbindung. Sulfamid wurde erstmals im Jahre 1838 von dem französischen Chemiker Henri Victor Regnault dargestellt.[2] In der organischen Chemie wird der Name der Verbindung auch für die entsprechende funktionelle Gruppe verwendet, wobei in der Literatur der Name teilweise auch als Synonym für die allgemeinere Gruppe der Sulfonamide benutzt wird.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
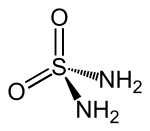 | ||||||||||||||||
| Keile zur Verdeutlichung der räumlichen Struktur | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Sulfamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SO2(NH2)2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 96,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,61 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Sulfamid kann durch Reaktion von Sulfurylchlorid oder Schwefeltrioxid[4] mit Ammoniak gewonnen werden.[5]
Eigenschaften
Sulfamid ist ein weißer geschmackloser Feststoff, der löslich in heißem Wasser, heißem Ethanol und Aceton ist.[1] Beim Erhitzen oberhalb 140 °C erfolgt die Umwandlung nach (NH4)3(SO2N)3. Es bildet mit Silbernitrat nur bei Zusatz von Ammoniak ein Silbersalz der Formel Ag2[SO2(NH)2], das in Wasser sehr schwer löslich ist.[5]
Verwendung
Durch Kondensation mit Formaldehyd in salzsaurer Lösung lässt sich Dithiatetraazaadamantantetroxid darstellen.[6][7]
Einzelnachweise
- Datenblatt Sulfamide, 99% bei AlfaAesar, abgerufen am 22. Dezember 2013 (PDF) (JavaScript erforderlich).
- Regnault, Victor (1838) "Sur l'acide chlorosulfurique et la sulfamide", Annales de chimie et de physique, series 2, 69 : 170-184 (Digitalisat auf Gallica); siehe auch "Action de gaz ammoniac sec sur la liqueur chlorosulfurique", S. 176–180.
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. Springer DE, 2005, ISBN 3-528-64609-8, S. 259 (eingeschränkte Vorschau in der Google-Buchsuche).
- Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1960, ISBN 0-08-057851-9, S. 185 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 490.
- G. Hecht, H. Henecka: Über ein hochtoxisches Kondensationsprodukt von Sulfamid und Formaldehyd. In: Angewandte Chemie. Band 61, Nr. 9, September 1949, S. 365–366, doi:10.1002/ange.19490610905.
- Eugen Müller: Neuere Anschauungen der organischen Chemie: Organische Chemie für Fortgeschrittene. 2. Auflage. Springer, 1957, S. 57, doi:10.1007/978-3-642-87591-5.
