Assoziation (Chemie)
Als Assoziation bezeichnet man in der Chemie die Zusammenlagerung zweier oder mehrerer gleichartiger Moleküle zu größeren Molekülverbänden, den Assoziaten, die früher auch Übermolekel genannt wurden.[1] Die Assoziation wird durch zwischenmolekulare Kräfte bewirkt. Assoziate können im gasförmigen oder flüssigen Aggregatzustand, aber auch in Lösungen vorliegen.
Die Assoziation ist ein Sonderfall der Aggregation.[2] Bestehen die Übermolekeln aus verschiedenen Molekülen, spricht man von Aggregaten. Die Wechselwirkung eines Moleküls mit Lösungsmittelmolekülen fällt nicht unter den Begriff Assoziation, sondern wird Solvatation genannt. Assoziation und Solvatation können jedoch miteinander konkurrieren.
Oft sind Wasserstoffbrückenbindungen ursächlich für die Bildung von Assoziaten. In gleichzähligen Assoziaten liegen stöchiometrisch definierte Assoziationskomplexe vor, die mit ihren Ausgangsprodukten im Gleichgewicht stehen. Im Falle von nur statistisch beschreibbaren ungleichzähligen Assoziaten wird der Begriff „Schwarmbildung“ benutzt.
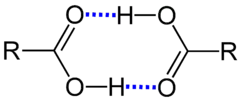

Beispiele
Beispiele sind die Zusammenlagerung von mehreren Wasser-Molekülen. Fluorwasserstoff liegt sogar in der Gasphase gleichzählig assoziiert vor. Oft liegen Carbonsäuren in flüssiger Phase und manchmal auch oberhalb des Siedepunktes als Dimere vor, beispielsweise Ameisensäure und Essigsäure. Alkohole bilden ebenso wie Phenole ungleichzählige Assoziate.[3]
Ein weiteres Beispiel ist die Ionenassoziation, beispielsweise beim Lösen von Salzen in wässriger Lösung.
Die hydrophobe Assoziation – Zusammenlagerung organischer Moleküle oder Molekülteile in wässriger Umgebung – ist ein weiteres Beispiel. Dies spielt die z. B. bei der Biomembranbildung und bei der Proteinfaltung eine grundlegende Rolle. Bei dieser Art der Assoziation spielen weniger intermolekulare Wechselwirkungen eine Rolle, sondern hier ist ein Entropiegewinn die treibende Kraft für die Assoziation.
Einzelnachweise
- Der Brockhaus, Naturwissenschaft und Technik, F. A. Brockhaus, Mannheim; Spektrum Akademischer Verlag, Heidelberg, 2003.
- Eintrag zu Assoziation. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 115.