3-Amino-2-butensäuremethylester
3-Amino-2-butensäuremethylester ist eine industriell hergestellte chemische Verbindung, ein Ester der ungesättigten Crotonsäure, welche an der C=C-Doppelbindung durch eine Aminogruppe substituiert ist. Die Chemikalie wird u. a. zur Herstellung von 1,4-Dihydropyridinen verwendet, vor allem für den Arzneistoff Nitrendipin. Oft wird die Verbindung mit dem Halbtrivialnamen β-Aminocrotonsäuremethylester bezeichnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-3-Amino-2-butens%C3%A4ure-methylester.svg.png.webp) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Amino-2-butensäuremethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H9NO2 | ||||||||||||||||||
| Kurzbeschreibung |
Schwache Base, eine wässrige Lösung von 18 g/l zeigt bei 20 °C einen pH-Wert 8–9[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 115,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
Feststoff | ||||||||||||||||||
| Schmelzpunkt |
81–83 °C[1] | ||||||||||||||||||
| Siedepunkt |
112 °C bei 55 hPa[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Struktur
Da die Kohlenstoffatome der C=C-Doppelbindung mit ungleichen Atomen bzw. Gruppen (Liganden) verknüpft sind, werden zwei stereoisomere Formen möglich (Konfigurationsisomere). Diese können als (Z)- bzw. (E)-Isomer bezeichnet werden (die vielverwendeten Begriffe cis und trans sind hier nicht eindeutig, wurden aber dennoch verwendet).
| Isomere von 3-Amino-2-butensäure-methylester | ||
| Name | (Z)-3-Amino-2-butensäure-methylester | (E)-3-Amino-2-butensäure-methylester |
| Strukturformel | 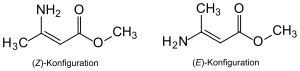 | |
| CAS-Nummer | 21731-17-9 | 80012-11-9 |
| 14205-39-1 (unspez.) | ||
| EG-Nummer | 244-549-6 | – |
| 238-056-5 (unspez.) | ||
| ECHA-Infocard | 100.040.484 | – |
| 100.034.581 (unspez.) | ||
| PubChem | – | – |
| 643918 (unspez.) | ||
| Wikidata | − | − |
| Q72486828 (unspez.) | ||
Herstellung
3-Amino-2-butensäuremethylester wird durch Umsetzung von Acetessigsäuremethylester mit Ammoniak gewonnen. Die Reaktion beginnt mit der Addition von NH3 an die C=O-Gruppe des β-Ketoesters. Darauf wird H2O eliminiert, wodurch die C=C-Doppelbindung erzeugt wird. Prinzipiell kann dies zum (E)- oder (Z)-Stereoisomer führen.
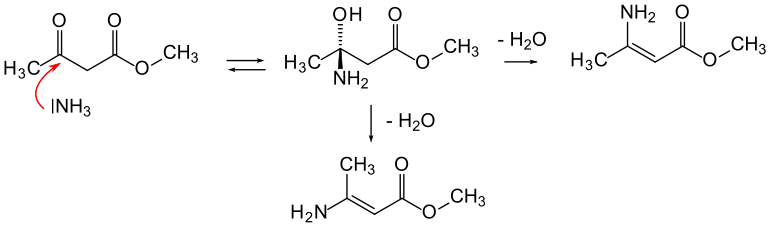
Für die Herstellung wurden bisher konventionelle Apparaturen verwendet. Neuerdings wurde über eine Synthese in einem Röhrenreaktor unter continuous flow Bedingungen berichtet. Die Reaktion wird in wässrigem Milieu ohne organische Lösungsmittel durchgeführt.[2]
Eigenschaften
Physikalische Eigenschaften
Nach NMR-Studien besteht eine intramolekulare Wasserstoffbrückenbindung zwischen dem Carbonylsauerstoffatom und der Aminogruppe (Chelat); diese ist beim (E)-Isomer nicht möglich.[3][4]
Die Kombination der Aminogruppe mit der C=C-Doppelbindung wird Enamin genannt. Durch die Wechselwirkung des „freien“ Elektronenpaars am N-Atom wird die Elektronendichte am C-2-Atom erhöht. Darüber hinaus tritt das freie Elektronenpaar der Aminogruppe mit der Carbonylgruppe des Carbonsäureesters in Wechselwirkung (Konjugation). Im Formalismus der Valenzstrukturtheorie können die Bindungsverhältnisse als Mesomerie mit den abgebildeten Grenzformeln beschrieben werden.
-3-Amino-2-butens%C3%A4ure-methylester.svg.png.webp)
Chemische Eigenschaften
Als ambifunktionelles (ambidentes) Enamin kann die Verbindung von elektrophilen Agenzien nicht nur an der Aminogruppe, sondern auch am C-2-Atom angegriffen werden. Besonders interessant sind Reaktionen, die zur C-C-Verknüpfung führen, da auf diese Weise größere Moleküle synthetisiert werden können. So entsteht mit Benzoylchlorid sowohl 3-Benzoylamino-2-butensäure-methylester als auch 3-Amino-2-benzoyl-2-butensäure-methylester.[5]
Unter diesen Reaktionen sticht die Michael-Addition heraus, z. B. mit Acrylnitril, die zum 3-Amino-2-cyanoethyl-2-butensäuremethylester führt. Auf diesem Prinzip beruhen auch Synthesen von Amlodipin, Nitrendipin und Carboxy-nifedipin.[6]
Einzelnachweise
- Datenblatt 3-Amino-crotonsäure-methylester bei Sigma-Aldrich, abgerufen am 8. April 2021 (PDF).
- Ramesh A. Joshi, Rohini R. Joshi, Jagdish Tibhe, Nayana T. Nivangune, Amol A. Kulkarni: Continuous flow synthesis of β-amino-α,β-unsaturated esters in aqueous medium. In: Green Process Synth Jg. 2012, Bd. 1, S. 205–210. doi:10.1515/gps-2011-0002
- A. Gómez Sánchez, M. Tena Aldave, U. Scheidegger: Proton magnetic resonance spectra of N-substituted 3-aminocrotonic esters. In: Journal of the Chemical Society C: Organic Chemistry. 1968, S. 2570, doi:10.1039/j39680002570.
- A. Gómez Sánchez, A. M. Valle, J. Bellanato: Infrared and nuclear magnetic resonance absorption and isomerism of 3-aminocrotonic esters. Part II. In: J. Chem. Soc., Perkin Trans. 2. Nr. 1, 1973, S. 15, doi:10.1039/p29730000015.
- Robert T. Buckler, Harold E. Hartzler, Barrie M. Phillips: Antiinflammatory β-Arylamidoacrylic acids, In: Journal of Medical Chemistry, Jg. 1975, Bd. 18, Heft 5, S. 509–513; doi:10.1021/jm00239a015
- Clare J. Biswas, Terry B. Rogers, Synthesis of carboxy-nifedipine and its use in the preparation of an affinity resin for the 1,4-dihydropyridine receptor, In: Biochemical and Biophysical Research Communications, Jg. 1986, Bd. 134, Heft 2, S. 922–927, doi:10.1016/S0006-291X(86)80508-3.

