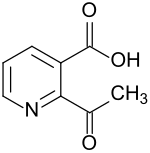
2-Acetylnicotinsäure
2-Acetylnicotinsäure ist als sechsgliedriger Heterocyclus mit einem Stickstoffatom ein Derivat des Pyridins, das in 3-Stellung eine Carboxygruppe trägt. Diese mit dem Trivialnamen Nicotinsäure bezeichnete Pyridin-3-carbonsäure weist außerdem in 2-Position eine Acetylgruppe auf. 2-Acetyl-3-pyridincarbonsäure ist der Ausgangsstoff für das Herbizid Diflufenzopyr.[8]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Acetylnicotinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H7NO3 | ||||||||||||||||||
| Kurzbeschreibung |
schwach beiger Feststoff[1] bzw. weiße nadelförmige Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 165,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser und in Methanol[1], Toluol, MTBE, Ethylacetat und n-Butanol[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Die Synthese von 2-Acetylnicotinsäure wurde erstmals von Otto Rosenheim und Julius Tafel 1893 als α-Acetonicotinsäure beschrieben.[2] Dabei wurde 6-Hydroxychinolin (heutzutage in einer modifizierten Skraup-Synthese als Eintopf-Domino-Reaktion mit Bamberger-Umlagerung in einfacher Weise und guter Ausbeute (77 %) aus Nitrobenzol und Glycerin zugänglich)[9] mit Chlorkalk oxidiert. Das Oxidationsprodukt wird nach Ansäuern beim Erhitzen auf 140 °C in 2-ANA umgewandelt.

Bei der Ozonolyse von 8-Methylchinolin als Ausgangsverbindung (durch Doebner-Miller-Reaktion aus o-Toluidin, Schwefelsäure, Natriumiodid und Glycerin[4]) wird 2-ANA in 70 %iger Ausbeute erhalten.[4] Geringere Verunreinigungen durch am Pyridinring methylierte Nebenprodukte werden beim Durchleiten von Sauerstoff durch das Reaktionsgemisch nach der Ozonolyse erzielt.[5]
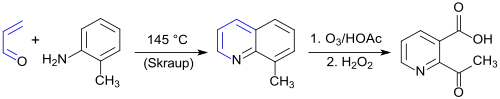
Wegen des hohen Explosionsrisikos ist die Ozonolyse als industrielles Verfahren zur Herstellung von 2-Acetyl-3-pyridincarbonsäure obsolet.
Eine Alternative bietet der Syntheseweg ausgehend von Nicotinsäure (z. B. nach einem Verfahren der Lonza Group AG durch Oxidation von 5-Ethyl-2-methylpyridin (MEP) mittels Salpetersäure[10]) und Oxidation zum Nicotinsäure-N-oxid mittels Wasserstoffperoxid[11], dessen Umsetzung mit Essigsäureanhydrid[12], anschließender Deoxygenierung des N-Oxids und Ringspaltung zum Endprodukt 2-Acetylnicotinsäure.[13]
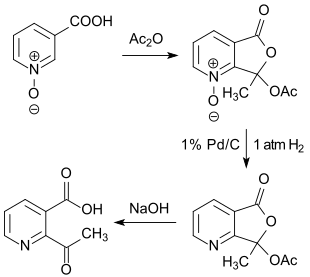
Das Reinprodukt wird dabei in Gesamtausbeuten um 40 %, bezogen auf Nicotinsäure, erhalten.
Eigenschaften
2-Acetylnicotinsäure fällt bei der industriellen Synthese als beigefarbener Feststoff an, der als Reinsubstanz in weißen Nadeln kristallisiert. Die Verbindung ist in heißem Wasser sehr leicht löslich und kann zur Reinigung daraus umkristallisiert werden. Auch Alkohole, Aceton und Ethylacetat[2], sowie Toluol, MTBE und n-Butanol[5] lösen 2-ANA.
Anwendungen
2-Acetylnicotinsäure reagiert mit Hydrazin unter Bildung eines bicyclischen Ringsystems vom Typ eines Pyrido-pyrazins.[14]
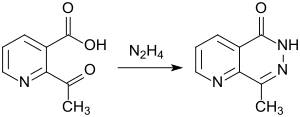
Funktionalisierte Pyrido [2,3-d] pyrazine wurden als mögliche Herbizide synthetisiert und getestet.[15]
Die Hauptanwendung von 2-Acetylnicotinsäure liegt in der Synthese des Auxintransport-Inhibitors Diflufenzopyr, der zur Wirkungsverstärkung von Herbiziden vom Typ der synthetischen Auxine, wie z. B. Dicamba, eingesetzt wird.[8]
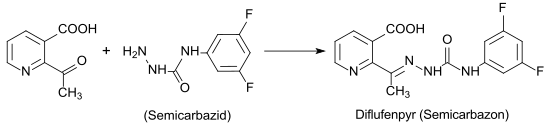
Das Semicarbazon-Derivat Diflufenzopyr ist in den USA und Kanada zugelassen, nicht jedoch in der EU.
Einzelnachweise
- Patent US5098462: Substituted semi-carbazones and related compounds. Angemeldet am 23. Mai 1988, veröffentlicht am 24. März 1992, Anmelder: Sandoz Ltd., Erfinder: R.J. Anderson, M.M. Leippe, J.T. Bamberg.
- O. Rosenheim, J. Tafel: Ueber die Oxydation des p-Oxychinolins. In: Ber. Dtsch. Chem. Ges. Band 26, Nr. 2, 1893, S. 1501–1513, doi:10.1002/cber.18930260265.
- H. Nagano, M. Hamana, Y. Nawata, S. Prachayasittikul, A.N. Abdel-Sayed, L. Bayer: Reinvestigation of the reaction of nicotinic acid 1-oxide with acetic anhydride. In: Heterocycles. Band 26, Nr. 5, 1987, S. 1263–1270, doi:10.3987/R-1987-05-1263.
- C. O’Murchu: Ozonolysis of quinolines: A versatile synthesis of polyfunctional pyridines. In: Synthesis. Band 11, 1989, S. 880–882, doi:10.1055/s-1989-27423.
- Patent WO199967217: Verbessertes Verfahren zur Herstellung von substituierten Pyridincarbonsäuren. Angemeldet am 4. Juni 1999, veröffentlicht am 29. Dezember 1999, Anmelder: DSM Fine Chemical Austria GmbH, Erfinder: G. Steinbauer, C. Zimmermann, E. Wressnegger, E. Steinwender.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-Acetylnicotinic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 17. Januar 2020.
- 2-Acetonicotinic acid - ChemSpider. Abgerufen am 21. Februar 2022: „Siehe Properties, dann Safety“
- K. Paranjape, V. Gowariker, V.N. Krishnamurthy, S. Gowariker: The Pesticide Encyclopedia. CABI, Wallingford, UK 2015, ISBN 978-1-78064-014-3, S. 163.
- H. Saggadi, D. Luart, N. Thiebault, I. Polaert, L. Estel, C. Len: Toward the synthesis of 6-hydroxyquinoline starting from glycerol via improved microwave-assisted modified Skraup reaction. In: Catal. Commun. Band 44, 2014, S. 15–18, doi:10.1016/j.catcom.2013.07.029.
- Patent DE1956117: Verfahren zur Herstellung von Pyridincarbonsäuren. Angemeldet am 7. November 1969, veröffentlicht am 11. Juni 1970, Anmelder: Lonza AG, Erfinder: A. Stocker, O. Marthi, T. Pfammatter, G. Schreiner.
- E.C. Taylor, A.J. Crovetti: Pyridine-1-oxide. I. Synthesis of some nicotinic acid derivatives. In: J. Org. Chem. Band 19, Nr. 10, 1954, S. 1633–1640, doi:10.1021/jo1375a012.
- B.M. Bain, J.E. Saxton: 1031. The reaction of nicotinic acid 1-oxide and 3-picoline 1-oxide with acetic acid. In: J. Chem. Soc. 1961, S. 5216–5223, doi:10.1039/JR96100005216.
- M.S. Moon, S.H. Lee, C.S. Cheong: A practical synthesis of nicotinic acid derivatives by palladium on charcoal. In: Bull. Korean Chem. Soc. Band 22, Nr. 10, 2001, S. 1167–1168 (koreascience.or.kr).
- N.N. Smolyar, Y.M. Yutilov: Cyclotransformation in the series of fused 5-nitropyridin-2(1H)-ones. In: Russ. J. Org. Chem. Band 44, Nr. 2, 2008, S. 274–281, doi:10.1134/S1070428008020152.
- Patent EP0555957A1: Pyrido 2,3-d pyridazine derivatives as herbicides. Angemeldet am 12. Januar 1993, veröffentlicht am 18. August 1993, Anmelder: Rhone-Poulenc Agriculture Ltd., Erfinder: R. Hewitt, S.N. Pettit, P. Smith.
