Doebner-Miller-Reaktion
Die Doebner-Miller-Reaktion, auch bekannt als Doebner-Miller-Synthese, Doebner-von Miller-Chinolinsynthese oder Doebner-Miller-Kondensation, ist eine Namensreaktion der organischen Chemie. Die Reaktion wurde im Jahre 1881[1] von den deutschen Chemikern Oskar Doebner (1850–1907) und Wilhelm von Miller (1848–1899) als Erweiterung der Skraup-Synthese[2] – benannt nach dem tschechischen Chemiker Zdenko Hans Skraup – veröffentlicht.[3][4] Die Reaktion wird daher auch Skraup-Doebner-von Miller-Chinolinsynthese genannt. Es handelt sich bei der Reaktion um eine Kondensationsreaktion von primären aromatischen Aminen (z. B. Anilin) und α,β-ungesättigten Carbonylverbindungen (zumeist α,β-ungesättigte Aldehyde) zu Chinolinderivaten.[5][6][7][8]
Übersicht
Bei dieser säurekatalysierten Reaktion bilden Aniline (hier unsubstituiertes Anilin) und α,β-ungesättigte Carbonylverbindungen 2,3-disubstituierte Derivate des Chinolins.
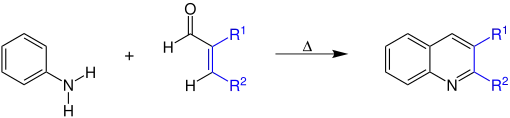
R1 und R2 sind organische Reste, z. B. Alkylreste
Mechanismus
Der Mechanismus der Reaktion wird hier am Beispiel der Reaktion von Anilin und einem α,β-ungesättigten Aldehyd dargestellt. Am Schluss wird Iod als Oxidationsmittel eingesetzt. R1 und R2 sind organische Reste.[1] Auch in jüngerer Zeit (2006) ist die Reaktion noch Gegenstand mechanistischer Studien unter Zuhilfenahme von Isotopenmarkierungsexperimenten gewesen, vorgeschlagen wurde ein Fragmentierungs-Rekombinationsmechanismus.[9]
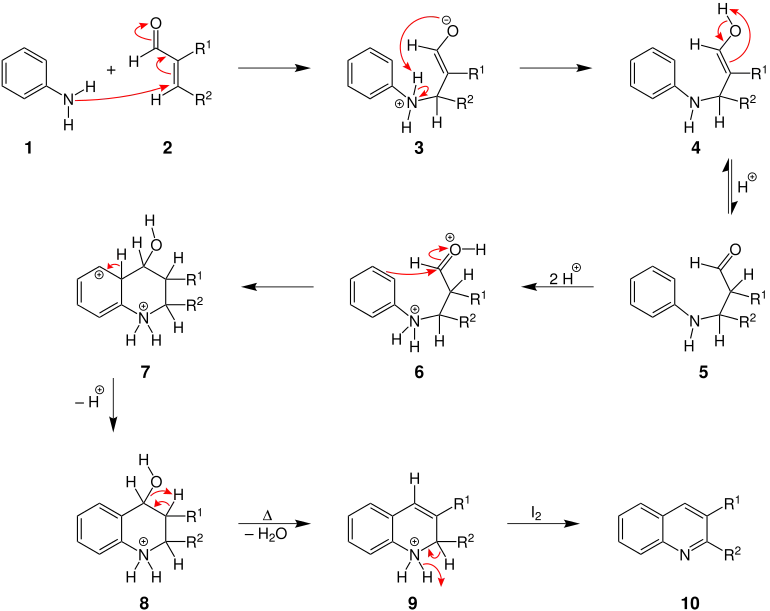 Reaktionsmechanismus der Doebner-Miller-Reaktion
Reaktionsmechanismus der Doebner-Miller-Reaktion
Zu Beginn greift die Aminogruppe des Anilins (1) die polarisierte C=C-Doppelbindung in dem α,β-ungesättigten Aldehyd 2 an, was zur Ausbildung eines Enolats 3 führt. Auf eine 1,5-Protonenübertragung 3 folgt eine Tautomerisierung vom entstandenen Enol 4 zum entsprechenden Keton 5. Eine Protonierung der Carbonyl- und der Aminogruppe von 5 führt zu 6. Im Anschluss daran wird im Zuge einer intramolekularen elektrophilen aromatischen Substitution über einen Zwischenzustand 7 ein heterocyclischer Sechsring geschlossen 8. Unter Wärmezufuhr wird Wasser abgespalten und eine C=C-Doppelbindung ausgebildet 9. Abschließend wird das Molekül 9 mit Iod zu einem 2,3-disubstituierten Chinolinderivat 10 oxidiert.
Modifizierung
Im Jahre 1886 wurde die Reaktion dann von Carl Beyer (Beyer-Methode) dahingehend modifiziert, dass 2,4-disubstituierte Chinolinderivate entstehen. Dabei werden Aniline mit α,β-ungesättigten Carbonylverbindungen umgesetzt, die in situ aus Aldehyden oder einem Gemisch von Aldehyden und Methylketonen hergestellt werden. R1 und R2 sind organische Reste.[1][10]
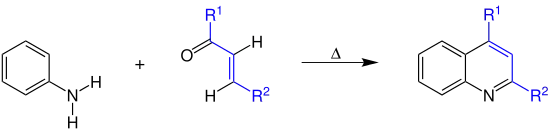 Beyer-Modifizierung
Beyer-Modifizierung
Siehe auch
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 924–929.
- Zd. H. Skraup: Eine Synthese des Chinolins. In: Monatshefte für Chemie. Band 1, Nr. 1, 1880, S. 316–318, doi:10.1007/BF01517073.
- O. Doebner, W. v. Miller: Ueber eine dem Chinolin homologe Base. In: Berichte der deutschen chemischen Gesellschaft. Band 14, Nr. 2, 1881, S. 2812–2817, doi:10.1002/cber.188101402258.
- O. Doebner, W. v. Miller: Ueber Phenylchinolin. In: Berichte der deutschen chemischen Gesellschaft. Band 16, Nr. 2, 1883, S. 1664–1667, doi:10.1002/cber.18830160238.
- J. J. Li: Name Reactions. A Collection of Detailed Reaction Mechanisms. 3. erweiterte Auflage, Springer, Berlin/Heidelberg 2006, ISBN 978-3-540-30030-4, S. 196–197.
- O. Doebner, W. v. Miller: Ueber Chinaldinbasen. In: Berichte der deutschen chemischen Gesellschaft. Band 16, Nr. 2, 1883, S. 2464–2472, doi:10.1002/cber.188301602176.
- O. Doebner, W. v. Miller: Ueber Chinaldinbasen. In: Berichte der deutschen chemischen Gesellschaft. Band 17, Nr. 2, 1884, S. 1698–1712, doi:10.1002/cber.18840170231.
- O. Doebner, W. v. Miller: Ueber die Homologen des Chinaldins. In: Berichte der deutschen chemischen Gesellschaft. Band 17, Nr. 2, 1884, S. 1712–1721, doi:10.1002/cber.18840170232.
- Scott Denmark, Srikanth Venkatraman: On the Mechanism of the Skraup−Doebner−Von Miller Quinoline Synthesis. In: The Journal of Organic Chemistry. Vol. 71, Nr. 4, 2006, S. 1668–1676, doi:10.1021/jo052410h, PMID 16468822 (englisch).
- C. Beyer: Über α-γ-Dimethylchinolin und die Synthese des Cincholepidins und des γ-Phenylchinaldins. In: Journal für Praktische Chemie. Band 33, Nr. 1, 1886, S. 393–425, doi:10.1002/prac.18860330136.