Bamberger-Umlagerung
Die Bamberger-Umlagerung ist eine Reaktion aus dem Bereich der Organischen Chemie und nach ihrem Entdecker, dem deutschen Chemiker Eugen Bamberger (1857–1932), benannt. Die Reaktion dient der Synthese von para-Hydroxyanilin-Derivaten aus Phenylhydroxylamin-Derivaten in Gegenwart starker wässriger Säuren.[1][2]
-Portrait-Portr_00015.tif_(cropped).jpg.webp)
Reaktionsmechanismus
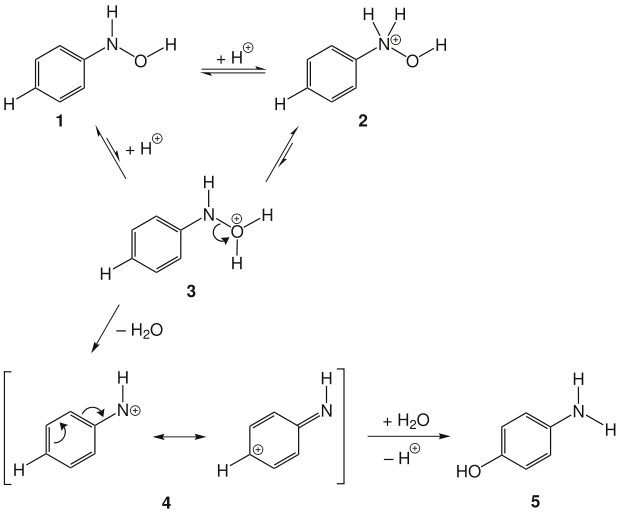
Die Reaktion beginnt mit der reversiblen Protonierung des Phenylhydroxylamins 1. Die Protonierung des Stickstoffatoms wird bevorzugt und führt zu 2, ist jedoch für die gewünschte Reaktion unproduktiv. Wird der Hydroxy-Sauerstoff protoniert (3), kann unter Bildung eines mesomeriestabilisierten Nitreniumions 4 Wasser abgespalten werden. Nun folgt ein nukleophiler Angriff eines Wassermoleküls am Aromaten. Daraus entsteht nach Rearomatisierung das Produkt 5.[3][4]
Einzelnachweise
- Eug. Bamberger: Ueber das Phenylhydroxylamin. In: Berichte der deutschen chemischen Gesellschaft. 27, Nr. 2, 1894, S. 1548–1557, doi:10.1002/cber.18940270276.
- P. W. Oxley, B. M. Adger, M. J. Sasse, M. A. Forth: N-Acetyl-N-phenylhydroxylamine via Catalytic Transfer Hydrogenation of Nitrobenzene using Hydrazine and Rhodium on Carbon In: Organic Syntheses. 67, 1989, S. 187, doi:10.15227/orgsyn.067.0187; Coll. Vol. 8, 1993, S. 16 (PDF).
- Takaaki Sone, Kazuhiro Hamamoto, Yoshiyuki Seiji, Seiji Shinkai, Osamu Manabe: Kinetics and mechanisms of the Bamberger rearrangement. Part 4. Rearrangement of sterically hindered phenylhydroxylamines to 4-aminophenols in aqueous sulphuric acid solution. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 12, 1981, S. 1596–1598, doi:10.1039/p29810001596.
- George Kohnstam, W. Andrew Petch, D. Lyn H. Williams: Kinetic substituent and isotope effects in the acid-catalysed rearrangement of N-phenylhydroxylamines. Are nitrenium lons involved? In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 3, 1984, S. 423–427, doi:10.1039/P29840000423.