2,6-Dibrompyridin
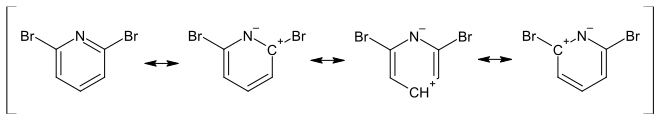
2,6-Dibrompyridin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie besteht aus einem Pyridinring, der in 2- und 6-Position mit Brom substituiert ist. Eine elektrophile aromatische Substitution ist in 4-Position durch die mesomeren Grenzstrukturen erschwert, an den Positionen 3 und 5 jedoch möglich, wenn auch nur mit starken Elektrophilen wie Nitroniumtetrafluoroborat.[2]
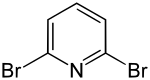
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,6-Dibrompyridin | |||||||||||||||
| Summenformel | C5H3Br2N | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 236,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
2,6-Dibrompyridin kann durch Reaktion von Pyridin-N-oxid mit tert-Butyllithium und Tetrabrommethan hergestellt werden.[3] Es fällt auch als Nebenprodukt bei der Synthese von 2-Brompyridin mit Brom bei 500 °C an.[4]
Verwendung
Durch Reaktion von 2-Brompyridin und 2,6-Dibrompyridin mit Kupfer im Sinne einer Ullmann-Kupplung kann Terpyridin hergestellt werden.[5]
Die Synthese von 3-Nitropyridin gelingt durch Reaktion von 2,6-Dibrompyridin mit Nitroniumtetrafluoroborat und anschließender Dehalogenierung.[6]
Einzelnachweise
- Datenblatt 2,6-Dibrompyridin (PDF) bei Merck, abgerufen am 25. Dezember 2019.
- J. L. Duffy, K. K. Laali: Aprotic Nitration (NO2+BF4−) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations. In: J. Org. Chem. 1991, 56, S. 3006–3009. doi:10.1021/jo00009a015
- I. Popov, H.-Q. Do, O. Daugulis: In Situ Generation and Trapping of Aryllithium and Arylpotassium Species by Halogen, Sulfur, and Carbon Electrophiles, in: J. Org. Chem., 2009, 74, S. 8309–8313; doi:10.1021/jo9015369.
- S. M. McElvain, M. A. Goese: The Halogenation of Pyridine, in: J. Am. Chem. Soc., 1943, 65, S. 2227–2233; doi:10.1021/ja01251a062.
- F. H. Burstall: Researches on the polypyridyls, in: J. Chem. Soc., 1938, S. 1662–1672; doi:10.1039/JR9380001662.
- Joseph L. Duffy, Kenneth K. Laali: "Aprotic Nitration (NO2+BF4−) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations", in: J. Org. Chem., 1991, 56, S. 3006–3009; doi:10.1021/jo00009a015.
