2,4-Dihydroxybenzoesäure
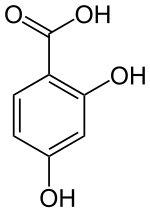
2,4-Dihydroxybenzoesäure (β-Resorcylsäure) ist eine aromatische Verbindung, die sich sowohl von der Benzoesäure als auch vom Resorcin (1,3-Dihydroxybenzol) ableitet. Die Struktur besteht aus einem Benzolring mit einer angefügten Carboxygruppe (–COOH) und zwei Hydroxygruppen (–OH) als Substituenten. Sie gehört zur Gruppe der Dihydroxybenzoesäuren.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,4-Dihydroxybenzoesäure | |||||||||||||||||||||
| Andere Namen |
β-Resorcylsäure | |||||||||||||||||||||
| Summenformel | C7H6O4 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 154,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
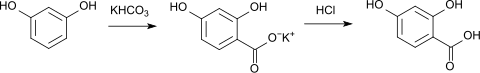
2,4-Dihydroxybenzoesäure kann aus Resorcin und Kaliumhydrogencarbonat durch die Kolbe-Schmitt-Reaktion hergestellt werden.[7][8]
Reaktionen und Derivate
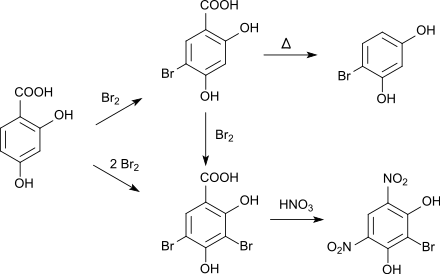
Die Bromierung von 2,4-Dihydroxybenzoesäure mit elementarem Brom in Eisessig führt zunächst zur 5-Brom-2,4-dihydroxybenzoesäure, das durch Decarboxylierung in 4-Bromresorcin umgewandelt werden kann.[9] Bei weiterer Zugabe von Brom bildet sich das 3,5-Dibromderivat. Wird letzteres mit Salpetersäure behandelt, entsteht unter Abspaltung der Carboxygruppe sowie eines Bromatoms 4,6-Dinitro-2-bromresorcin.[10][11]
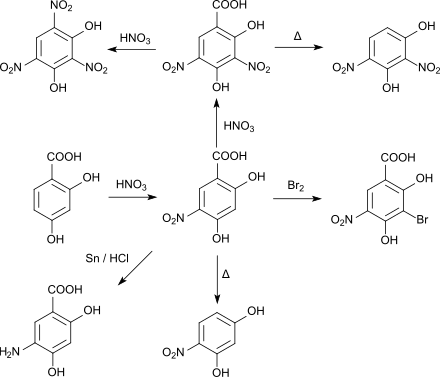
Die Nitrierung findet ebenfalls zunächst an der Position 5 statt. Wird dann mit rauchender Salpetersäure weiter nitriert, lagert sich eine zweite Nitrogruppe an der Position 3 an. Beim weiteren Behandeln mit Salpetersäure entsteht Styphninsäure.[12] Sowohl beim Mononitro- als auch beim Dinitroderivat kann durch Erhitzen die Carboxygruppe entfernt werden, es entstehen 4-Nitroresorcin bzw. 2,4-Dinitroresorcin.[13] 5-Nitro-2,4-dihydroxybenzoesäure kann mit Zinn und Salzsäure zur entsprechenden Aminoverbindung reduziert werden.[12]
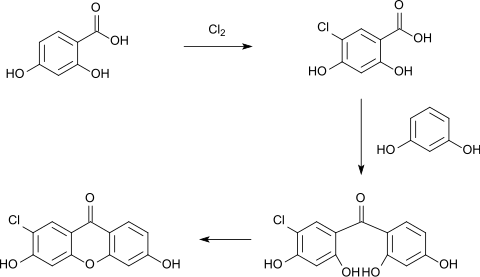
Beim Einleiten von Chlorgas in eine heiße Eisessiglösung der 2,4-Dihydroxybenzoesäure entstehen das 5-Chlor- (CAS-Nummer: 67828-44-8, Schmelzpunkt 224–225 °C) bzw. im Überschuss von Chlor das 3,5-Dichlorderivat (Schmelzpunkt 229 °C).[14][15] Diese 5-Chlor-2,4-dihydroxybenzoesäure kondensiert mit Resorcinen zu Tetrahydroxybenzophenonen, die unter Ringschluss zu den entsprechenden 7-Chlor-3,6-Dihydroxyxanthonen weiterreagieren. Wird anstelle der 5-Chlorsäure die 5-Nitrosäure verwendet, bleibt die Reaktion beim Keton stehen, der Ringschluss findet nicht statt.[16]
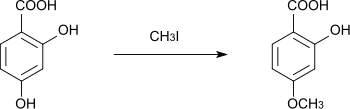
Beim Umsetzen mit Methyliodid in Methanol wird zunächst nur die para-ständige Hydroxygruppe methyliert, es entsteht 2-Hydroxy-4-methoxybenzoesäure.[17] Die Methylierung der zweiten Hydroxygruppe ist schwierig.[17] Ebenso kann mit Ethyliodid der p-Monoethylether erhalten werden.[18]
Beim längeren Erhitzen einer wässrigen Lösung des Natriumsalzes der 2,4-Dihydroxybenzoesäure (β-Resorcylsäure) findet eine teilweise Isomerisierung zur 2,6-Dihydroxybenzoesäure (γ-Resorcylsäure) statt.[19]
Ein naher Verwandter ist die Orsellinsäure, sie unterscheidet sich konkret von der 2,4-Dihydroxybenzoesäure durch eine 6-Methylgruppe.
Weblinks
- Beilstein (Syst.Nr. 1105), Bd. 10: H 377, EI 176, EII 251
- M. Nierenstein, D. A. Clibbens: β-Resorcylic Acid In: Organic Syntheses. 10, 1930, S. 94, doi:10.15227/orgsyn.010.0094; Coll. Vol. 2, 1943, S. 557 (PDF).
Einzelnachweise
- Datenblatt 2,4-Dihydroxybenzoesäure bei AlfaAesar, abgerufen am 28. November 2011 (PDF) (JavaScript erforderlich).
- Datenblatt 2,4-Dihydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 3. November 2016 (PDF).
- B. N. Mattoo: On the Complete Dissociation of 2:4 Dihydroxy Benzoic (β-Resorcylic) Acid. In: Zeitschrift für Physikalische Chemie, 1959, 22 (3–4), S. 187–198 (doi:10.1524/zpch.1959.22.3_4.187).
- Datenblatt 2,4-Dihydroxybenzoesäure bei Acros, abgerufen am 28. November 2011.
- Free Online Encyclopedia: β-resorcylic acid, abgerufen am 31. Januar 2017.
- Eintrag zu 2,4-Dihydroxybenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 351–352.
- S. v. Kostanecki: Zur Einführung der Carboxylgruppe in die Phenole in: Berichte der deutschen chemischen Gesellschaft, 18, S. 3202–3206 (1885).
- R. B. Sandin, R. A. McKee: 4-Bromoresorcinol In: Organic Syntheses. 17, 1937, S. 23, doi:10.15227/orgsyn.017.0023; Coll. Vol. 2, 1943, S. 100 (PDF).
- F. v. Hemmelmayr: Über einige neue Derivate der Dioxybenzoesäuren, in: Monatshefte für Chemie, 1912, 33, S. 971–998 (doi:10.1007/BF01552742).
- J. Zehenter: Über einige Derivate der α-Dioxybenzoesäure, in: Monatshefte für Chemie, 1881, 2, S. 468–483 (doi:10.1007/BF01516530).
- F. v. Hemmelmayr: Über die Einwirkung von Salpetersäure auf β-Resorcylsäure und einige Derivate der letzteren, in: Monatshefte für Chemie, 1904, 25 (1), S. 21–45 (doi:10.1007/BF01540190).
- F. v. Hemmelmayr: Über Nitroderivate der β-Resorcylsäure [2,4-Dioxybenzencarbonsäure], in: Monatshefte für Chemie, 1905, 26 (2), S. 185–198 (doi:10.1007/BF01532170).
- F. Hemmelmayr, T. Meyer: Über den Einfluß verschiedener Substituenten auf die Haftfestigkeit der Karboxylgruppen in substituierten aromatischen Säuren. Einfluß einer zweiten Karboxylgruppe und relative Wirkung von Chlor und Brom, in: Monatshefte für Chemie, 1925, 46, S. 143–156 (doi:10.1007/BF01558962).
- R. B. Sandin, R. A. McKee: Orientation in the Benzene Ring. The Preparation of 5-Chloro-β-resorcylic Acid, in: J. Am. Chem. Soc., 1935, 57 (6), S. 1077–1078. doi:10.1021/ja01309a032.
- R. Kurduker, N. V. Subba Rao: Search for physiologically active compounds in Proceedings of the Indian Academy of Sciences – Section A 1963, 57(5), S. 280–287. doi:10.1007/BF03049025.
- F. Tiemann, A. Parrisius: Ueber Abkömmlinge des Resorcins, in: Berichte der deutschen chemischen Gesellschaft 1880, 13, S. 2354–2381 (Volltext).
- S. v. Kostanecki, J. Tambor: Ueber die Constitution des Fisotins, in: Berichte der deutschen chemischen Gesellschaft 1895, 28, S. 2302–2309 (Volltext).
- D. K. Hale, A. R. Hawdon, J. I. Jones and D. I. Packham: The carboxylation of resorcinol and the separation of β-and γ-resorcylic acid by ion-exchange chromatography, in: J. Chem. Soc., 1952, S. 3503–3509 (doi:10.1039/JR9520003503).
