10,12-Docosadiin-1,22-disäure
10,12-Docosadiin-1,22-disäure ist eine langkettige lineare Dicarbonsäure mit mittelständiger konjugierter Diacetylen-Gruppe, deren Kristalle sich durch Druck, Wärmebehandlung und insbesondere durch energiereiche Strahlung (UV- oder Gamma-Strahlung) oberflächlich intensiv blau und bei Erhitzen über 120 °C irreversibel rot färben.[4] Die Dicarbonsäure weist ausgeprägt hydrophobe und hydrophile Molekülstrukturen auf und ist Ausgangsverbindung so genannter Bolaamphiphile in Anlehnung an die Wurfwaffe südamerikanischer Gauchos.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
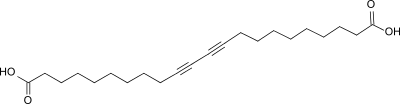 | ||||||||||
| Allgemeines | ||||||||||
| Name | 10,12-Docosadiin-1,22-disäure | |||||||||
| Summenformel | C22H34O4 | |||||||||
| Kurzbeschreibung |
weißer bis blauer Feststoff oder Flocken,[1] hellgraues Pulver[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 362,50 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2], löslich in Methanol[4], Dichlormethan[5], Chloroform[6] und Tetrahydrofuran[7] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Herstellung
10,12-Docosadiindisäure wird in einer oxidativen Dimerisierung im Sinne einer Glaser-Kupplung in Gegenwart von Kupfer(I)-chlorid bei 70 °C durch Einleiten von Luft in eine alkoholische Lösung von 10-Undecinsäure mit einer Ausbeute von 90 % erhalten.[4] In der Variante der Hay-Kupplung werden durch die lösungsvermittelnde Wirkung von TMEDA bereits bei Raumtemperatur und Sauerstoffeinleitung kürzere Reaktionszeiten bei sehr guten Ausbeuten erzielt.[9]
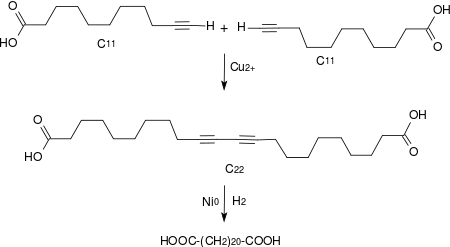
Durch vollständige katalytische Hydrierung der Diacetylen-Gruppe im Molekül entsteht die natürlich im Kork[10] vorkommende 1,22-Docosandisäure (Phellogensäure).[4]
Eigenschaften
10,12-Docosadiindisäure ist ein weißer kristalliner Feststoff, der bei UV-Bestrahlung topochemisch zu einem Polydiacetylen unter Ausbildung eines konjugierten mesomeren En-In-Bindungssystems polymerisiert. Der hohe Absorptionskoeffizient des entstandenen Chromophors bedingt eine intensiv blaue Färbung der Kristalloberflächen. Auch beim Tempern der Monomerkristalle konjugierter Diacetylene mit polaren Endgruppen unterhalb ihres Schmelzpunktes tritt eine Polymerisation zu tief gefärbten Polymerkristallen ein.[11]
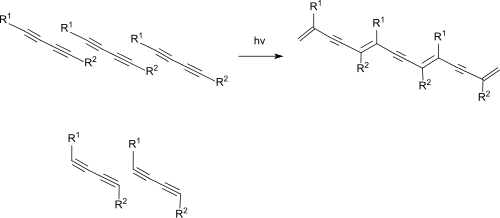
(Die gewinkelte Darstellung der Substituenten R1 und R2 in 1,4-Stellung der Diingruppe im unteren Bildteil entspricht nicht der darin vorliegenden sp-Hybridisierung (Bindungswinkel 180°), sondern dient der besseren Veranschaulichung der stattfindenden 1,4-Verknüpfung bei der Polymerisation der konjugierten Dreifachbindungen substituierter Diacetylene).
Die blaue Farbe geht beim Erhitzen über 120 °C irreversibel in Rot über.[4] Bei weiterem Erhitzen oder Bestrahlen sowie in bestimmten Lösungsmitteln können sich Polydiacetylene dauerhaft gelb verfärben.
Die Ursachen für die temperaturinduzierten Farbübergänge von Polydiacetylenen (Thermochromie) auf molekularer Ebene werden in der Literatur kontrovers diskutiert.[12] So soll der Blau-Rot-Farbwechsel auf einem Phasenübergang des Gesamtsystems aus Polymerkette, Alkylketten, sowie polaren und raumerfüllenden Endgruppen beruhen, der zur Deformation der konjugierten En-In-Polymerkette und damit der effektiven Konjugationslänge führt.
Anwendungen
10,12-Docosadiindisäure bildet mit 1,5-Diaminopentan ein Nylon-Salz ähnlich dem AH-Salz zur Herstellung von PA 6.6, aus dem zweidimensional vernetzte Polymere darstellbar sind.[13] Darin wird eine Polymerisationsebene durch die Polymerisation der Diacetylengruppen gebildet, die andere durch die Polykondensation des Nylon-Salzes, wobei ein Netzwerk von Polydiacetylenen entsteht, das in senkrechter Richtung über Polyamidketten verbunden ist. Unter Druck und Temperatur polymerisierte Formkörper aus solchen Nylon-Salzen zeichnen sich durch hohe Kristallinität, sowie Festigkeit und Steifigkeit aus, die mit der von Metallen vergleichbar ist.
Mit der Aminosäure Arginin bildet 10,12-Docosadiindisäure ebenfalls Salze, die in Wasser Hydrogele bilden, in denen Nanofasern entstehen. Durch Bestrahlung mit UV-Licht kann in diesen Nanofasern eine topochemische Polymerisation zu Polydiacetylenen mit Farbänderung von weiß nach orange herbeigeführt werden.[14]
Die Injektion von 10,12-Docosadiindisäurelösungen in Lösungen von p-Xylylendiamin in THF erzeugt poröse kugelige Partikel spezifischer Porosität und Porengröße durch ionische Wechselwirkungen zwischen Carboxyl- und Aminogruppen.[7] Polymerisation mit UV-Licht (254 nm) führt zu blauen, nicht-fluoreszierenden Partikeln, die sich bei Erhitzen auf 110 °C für 36 Stunden rot färben und rote Fluoreszenz zeigen. Die Partikel zeigen hohe thermische Stabilität im Vergleich zu herkömmlichen Polydiacetylenmaterialien und eignen sich als chemische Sensoren.
Polymere 10,12-Docosadiindisäure bildet mit Zinkoxid Nanoverbundmaterialien, die in verschiedenen organischen Lösungsmitteln unterschiedliche Farbeffekte ergeben und sich als Sensoren für organische Flüssigkeiten eignen.[6] Filme ähnlicher Zusammensetzung können als chromatische Sensoren für Temperatur-, Chemikalien- und Materialbelastungen dienen, u. a. auch als Sensoren für Spuren von Sprengstoffen, wie Trinitrotoluol.[15]
Veresterung von 10,12-Docosadiindisäure mit Hydroxyazobenzolen und Cholesterol führt zu flüssig-kristallinen Materialien, die zu dünnen Filmen verarbeitet werden können. Die Filme können durch Bestrahlung mit einem Helium-Cadmium-Laser belichtet und das erhaltene Farbbild durch Abkühlen fixiert werden, was einen Zugang zu wiederbeschreibbaren Aufzeichnungsmaterialien ermöglichen könnte.[16]
Funktionelle Ester der 10,12-Docosadiindisäure bilden photopolymerisierbare Schichten auf festen Substraten, die durch einen fotolithografischen Prozess farbige Abbildungen liefern und sich für den Aufbau thermischer und chemischer Sensoren eignen. Die blaue, nicht-fluoreszierende Phase der polymeren Diester besitzt einen Absorptionspeak bei ca. 630–640 nm, die rote fluoreszierende bei ca. 540–550 nm.[5] Die bei Temperaturen über 78 °C auftretende irreversible Farbänderung von blau nach rot bei polymerer 10,12-Docosadiindisäure kann auch als Marker für die Einsatzfähigkeit von Munition nach intensiver Hitzeeinwirkung herangezogen werden.[17][18]
10,12-Docosadiin-1,22-disäure eignet sich auch zum Aufbau von Bolaamphiphilen, bei denen am Ende einer langen hydrophoben kohelnwasserstoffkette zwei polare Kopfgruppen sitzen. Die Umsetzung beider endständiger Carboxygruppen führt zu symmetrischen Bolaamphiphilen mit der schematischen Struktur (A)

Die Umsetzung nur einer Carboxygruppe oder die gezielte Derivatisierung beider mit unterschiedlichen und verschieden großen Substituenten führt zu unsymmetrischen Bolaamphiphilen der schematischen Struktur (B).
In Wasser bilden Bolaamphiphile lyotrope Phasen unterschiedlicher Formen, wie Kugeln, Zylinder, Scheiben oder Vesikel.[19]
Einzelnachweise
- GFS Organic Chemicals, 10,12-Docosadiynedioic acid 98 %, Item 3113, http://www.e-digitaleditions.com/i/83298/62
- Datenblatt 10,12-Docosadiynedioic acid 95% bei AlfaAesar, abgerufen am 20. Oktober 2014 (PDF) (JavaScript erforderlich).
- A. Alissandratos, N. Baudendistel, B. Hauer, K. Baldenius, S. Flitsch, P. Halling: Biocompatible functionalization of starch. In: Chem. Commun. Band 47, 2010, S. 683–685, doi:10.1039/C0CC02908D.
- A. Seher: Die Konstitution der Isan- und Isanolsäure. In: Liebigs Ann. Chem. Band 589, Nr. 3, 1954, S. 222–238, doi:10.1002/jlac.19545890308.
- J. Lee, O. Yarimaga, C.H. Lee, Y.-K. Choi, J.-M. Kim: Network polydiacetylene films: preparation, patterning and sensor applications. In: Adv. Funct. Mater. Band XX, 2011, S. 1–8, doi:10.1002/adfm.201002042.
- A. Wu, Y. Gu, H. Tian, J.F. Federici, Z. Iqbal: Effect of alkyl chain length on chemical sensing of polydiacetylenes and polydiacetylenes/ZnO nanocomposites. In: Colloid Polym. Sci. 2014, doi:10.1007/s00396-014-3365-y.
- Patent US20120315481: Porous diacetylene particles, synthesis method thereof. Angemeldet am 6. April 2012, veröffentlicht am 13. Dezember 2012, Anmelder: Korea University Research and Business Foundation, Erfinder: D.J. Ahn, D.H. Yang.
- Datenblatt 10,12-Docosadiynedioic acid, 95% bei AlfaAesar, abgerufen am 26. Dezember 2014 (PDF) (JavaScript erforderlich).
- A.S. Hay: Oxidative coupling of acetylenes. II. In: J. Org. Chem. Band 27, Nr. 9, 1962, S. 3320–3321, doi:10.1021/jo01056a511.
- F. Zetzsche, M. Bähler: Untersuchungen über den Kork VII. Phellogensäure (Beitrag zum Verhalten der α-Oxysäuren in der Kalischmelze). In: Helv. Chim. Acta. Band 14, Nr. 4, 1931, S. 852–856, doi:10.1002/hlca.19310140425.
- G. Wegner: Topochemical polymerization of monomers with conjugated triple bonds. In: Makromol. Chem. Band 154, 1972, S. 35–48, doi:10.1002/macp.1972.021540103.
- M. Schott: The colours of polydiacetylenes: a commentary. In: J. Phys. Chem. B. Band 110, 2006, S. 15864–15868, doi:10.1021/jp0638437 (ulsu.ru [PDF]).
- Patent US4814404: Diacetylene-nylon salt compound and method for production of two-dimensional macromolecular crystals and shaped articles using said compound. Angemeldet am 27. August 1987, veröffentlicht am 21. März 1989, Anmelder: Agency of Industrial Science & Technology, MITI, Erfinder: H. Matsuda, H. Nakanishi, M. Kato, Y. Tanaka, K. Nakayama.
- M. Mukai, M. Kogiso, M. Aoyagi, M. Asakawa, T. Shimizu, H. Minamikawa: Supramolecular nanofiber formation from commercially available arginine and a bola-type diacetylenic diacid via hydrogelation. In: Polymer J. Band 44, 2012, S. 646–650, doi:10.1038/pj.2012.46.
- A. Patlolla, J. L. Zunino III, D. P. Schmidt, Z. Iqbal, D. R. Skelton: ZnO:Polydiacetylene films as chromatic sensors. In: Tech Connect World. 2010 (techconnectworld.com (Memento vom 4. März 2016 im Internet Archive)).
- N. Tamaoki, Y. Aoki, M. Moriyama, M. Kidowaki: Photochemical phase transition and molecular realignment of glass-forming liquid crystals containing cholesterol/azobenzene dimesogenic units. In: Chem. Mater. Band 15, Nr. 3, 2003, S. 719–726, doi:10.1021/cm020234c.
- J.L. Zunino III, D.R. Skelton, Z. Iqbal: Thermal indicating paints for ammunition assurance
- Patent US8722418: Thermal indicating composition. Angemeldet am 6. März 2012, veröffentlicht am 13. Mai 2014, Anmelder: The United States of America as represented by the Secretary of the Army, Erfinder: J.L. Zunino III, Z. Iqbal.
- R. Nagarajan: Self-assembly of bola amphiphiles. In: Chem. Eng. Commun. Band 55, Nr. 1–6, 1987, S. 251–273, doi:10.1080/00986448708911931.