Hydroxyazobenzole
Hydroxyazobenzole sind organische Verbindungen aus der Gruppe der Azobenzole. Außerdem gehören sie zu den Azofarbstoffen.[1] Sie besitzen eine charakteristische Azogruppe, sowie zwei Benzolringe. Die Hydroxygruppe an einem der Benzolringe fungiert als Substituent. Theoretisch sind drei Konstitutionsisomere mit der Summenformel C12H10N2O möglich, die jeweils in zwei (E,Z)-Isomeren auftreten.
| Hydroxyazophenole | ||||||
| Name | 2-Hydroxyazobenzol | 3-Hydroxyazobenzol | 4-Hydroxyazobenzol | |||
| Andere Namen | o-Hydroxyazobenzol | m-Hydroxyazobenzol | p-Hydroxyazobenzol | |||
| Strukturformel oben: (E)-Isomer unten: (Z)-Isomer |
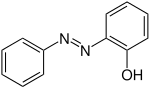 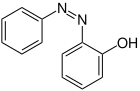 |
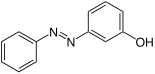 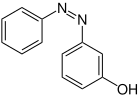 |
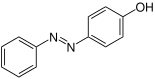 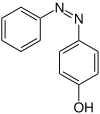 | |||
| CAS-Nummer |
|
|
| |||
| PubChem | 6506404 | 15723297 | 5354198 | |||
| Summenformel | C12H10N2O | |||||
| Molare Masse | 198,22 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Schmelzpunkt | 83 °C[1] | 114–115 °C[2] | 157,5–159,5 °C[2] | |||
| Siedepunkt | 230 °C[3] | |||||
| Löslichkeit | praktisch unlöslich in Wasser, gut in Diethylether und Ethanol[3] | |||||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | keine H-Sätze | keine H-Sätze | 315‐319‐335 | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| keine P-Sätze | keine P-Sätze | 261‐305‐338‐351 | ||||
Darstellung
Hydroxyazobenzole können durch Kupplungsreaktionen aus Diazoniumsalzen und Phenolen oder aromatischen Aminen hergestellt werden. Außerdem sind sie das Produkt der Wallach-Umlagerung. Bei dieser reagieren Azoxybenzole in saurem Milieu zu den Hydroxyazobenzolen, genauer zu p-Hydroxyazobenzol.[5] o-Hydroxyazobenzol entsteht zusätzlich zum p-Hydroxyazobenzol bei der Kupplung von Benzoldiazoniumchlorid mit Phenol. Das Produkt enthält aber nur höchstens 1 % des ortho-Isomers. Durch Wasserdampfdestillation kann dieses vom weniger flüchtigen para-Isomer getrennt werden. Außerdem entsteht die ortho-Verbindung, wenn die para-Stellung besetzt ist.
Isomerie
Neben den Konstitutionsisomeren m-,o-,p-Hydroxyazobenzol gibt es zu jedem der einzelnen Isomere noch ein E- und ein Z-Isomer. Alle Angaben in der nebenstehenden Tabelle beziehen sich auf das E,Z-Isomerengemisch, da es schwer ist die Isomere voneinander zu trennen.[6] Aufgrund von sterischen Hinderungen sind die E-Isomere stabiler, dennoch ist eine Umlagerung in die Z-Isomere möglich.[6][2]
Durch die Hydroxygruppe am Benzolring kann durch den mesomeren Effekt (+M-Effekt) die Elektronendichte im Benzolring erhöht werden. Der elektronenziehende induktive (−I)-Effekt wird dabei vom mesomeren Effekt überlagert.[7] Aufgrund dieser Effekte ist das p-Hydroxyazobenzol am stabilsten. Das m-Hydroxyazobenzol ist deswegen am instabilsten. Das o-Hydroxazobenzol liegt dazwischen.
Eigenschaften
Die Hydroxyazobenzole sind als stark wassergefährdend (WGK 3) eingestuft.[4] Aufgrund ihrer Azogruppe erscheinen die Hydroxyazobenzole farbig. Das p-Hydroxyazobenzol besitzt eine gelblich-orange Farbe und kristallisiert in Form von Prismen.[8] Das o-Hydroxyazobenzol erscheint in einem orangen Farbton.[1]
Verwendung
Die Hydroxyazobenzole werden, wie viele andere Azofarbstoffe auch, zur Färbung von Seifen, Lacke, Fette und Harze verwendet.[9]
Einzelnachweise
- Louis F. Fieser, Mary Fieser: Lehrbuch der Organischen Chemie. Chemie, Weinheim 1957, S. 713.
- Gavriella Gabor, Yael F. Frei, Ernst Fischer: Tautomerism and Geometric Isomerism in Arylazophenols and Napthols IV. – Spectra and Reversible Photoreactions of m- und p-Hydroxyazobenzene, J. Phys. Chem. 72 (1968), 3266–3272.
- Eintrag zu 4-(Phenylazo)phenol bei TCI Europe, abgerufen am 7. Mai 2014.
- Datenblatt 4-Phenylazophenol bei Sigma-Aldrich, abgerufen am 8. Mai 2014 (PDF).
- M. Windholz: The Merck Index. Merck&Co., Rahway 1976, ISBN 0-911910-26-3, S. ONR-92.
- Dietrich Schulte-Frohlinde: Über die thermische katalytische cis-trans-Umlagerung substituierter Azobenzole, Liebigs Ann. Chem. 612 (1958), 138–152.
- Charles E. Mortimer; Ulrich Müller: Chemie. Thieme, Stuttgart 2010, ISBN 978-3-13-484310-1, S. 549–550.
- Beyer, Walter: Lehrbuch der organischen Chemie. S. Hirzel Verlag, Stuttgart 2004, ISBN 3-7776-1221-9, S. 630 ff.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2942–2945.
