10-Undecinsäure
10-Undecinsäure ist eine längerkettige lineare ungesättigte Carbonsäure mit endständiger Ethinylgruppe, die durch Bromierung und Dehydrobromierung aus der einfach aus Rizinusöl zugänglichen 10-Undecensäure herstellen lässt und fungizide Eigenschaften besitzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
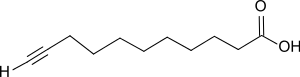 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 10-Undecinsäure | ||||||||||||||||||
| Summenformel | C11H18O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
10-Undecinsäure wird durch Addition von Brom an die endständige Doppelbindung von 10-Undecensäure und anschließende zweifache Abspaltung von Bromwasserstoff mit Natriumamid in flüssigem Ammoniak nach fraktionierter Destillation und zweimaliger Umkristallisation aus Petrolether in einer Ausbeute von 38–42 % d.Th. erhalten.[1]
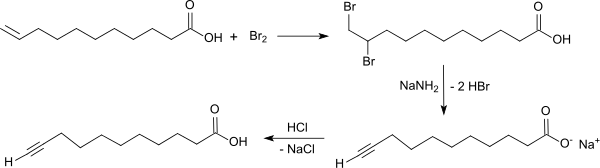
Die Reinausbeute beträgt nach einer ähnlichen Verfahrensvariante nach Verdampfen des Ammoniaks und einmaligem Umkristallisieren aus Hexan über 85 % d.Th.[7]
Die Dehydrobromierung liefert auch in wesentlich vereinfachter Weise unter Phasentransferbedingungen mit Aliquat 336 (Trioctylmethylammoniumchlorid) und gepulvertem Natriumhydroxid in 1,2-Dimethoxyethan 10-Undecinsäure mit einer Ausbeute von 81 % d.Th.[8] Ein ähnlicher Prozess ist auch in Polyethylenglycol als Lösungsmittel mit quantitativer Ausbeute beschrieben.[9]
Eigenschaften
10-Undecinsäure ist ein weißer bis schwach gelb gefärbter, geruchloser und kristalliner Feststoff,[4] der sich bei Raumtemperatur nur sehr wenig in Wasser löst. Dagegen ist die Säure in kurzkettigen Alkoholen, wie Methanol, Ethanol, Isopropanol, sowie in Dichlormethan und DMSO gut löslich. 10-Undecinsäure wird ohne Beleg als ein natürliches Fungizid („a natural fungicide“)[10] bezeichnet (die fungizide Wirkung der 10-Undecinsäure ist hingegen umfangreich belegt). In der Europäischen Union und in der Schweiz ist 10-Undecinsäure nicht als Pflanzenschutzwirkstoff zugelassen.[11]
Anwendungen
10-Undecinsäure eignet sich zur Stabilisierung von Gold-Nanoteilchen, indem eine damit versetzte Gold(III)-chlorid-Lösung neutralisiert und anschließend erhitzt wird, wobei die typisch leuchtend rote Farbe kolloidalen Golds auftritt.[5]
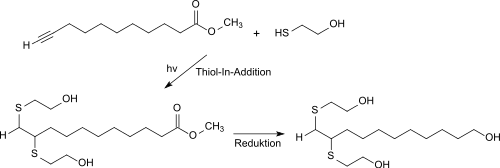
Aus 10-Undecinsäure ist durch Veresterung mit Methanol der 10-Undecinsäuremethylester erhältlich, der in einer Thiol-In-Kupplungsreaktion mit Mercaptoethanol zum 10,11-Bis(hydroxyethylthio)undecansäure-methylester umgesetzt werden und nach Reduktion der Methylestergruppe als Polyol-Komponente für Polyurethane mit guter Bioverträglichkeit Verwendung finden kann.[12]
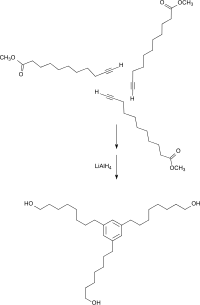
Der Methylester kann ferner durch übergangsmetallkatalysierte Cyclotrimerisierung und anschließende Hydrierung der Methylesterfunktion in ein für segmentierte Polyurethane interessantes sternförmiges Triol überführt werden.[13]
11-Iod-10-undecinsäure, die durch Iodierung von 10-Undecinsäure im Alkalischen entsteht, sowie deren Zinksalz und Phenylester zeigen bis zu 100-fach höhere fungizide Wirkung als 10-Undecensäure.[14]
Über ihre reaktive Ethinylgruppe kann 10-Undecinsäure in einer asymmetrischen Acetylen-Kupplung Cadiot-Chodkiewicz-Kupplung mit Bromalkinolen in Gegenwart von Kupfer(I)-chlorid zu langkettigen ω-Hydroxycarbonsäuren verknüpft werden.[8] die dazu benötigten Bromalkinole lassen sich durch Bromierung der Ethinylgruppe mit Hypobromit darstellen.
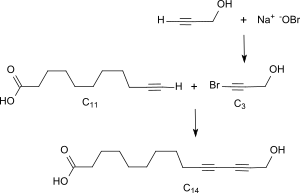
Mit 1-Brom-pentin-5-ol wird 14-Hydroxy-10,12-hexadecadiinsäure in einer Ausbeute von 75 % d.Th. erhalten und kann an einem Platinkontakt mit 98%iger Ausbeute zur gesättigten ω-Hydroxyhexadecansäure hydriert werden.
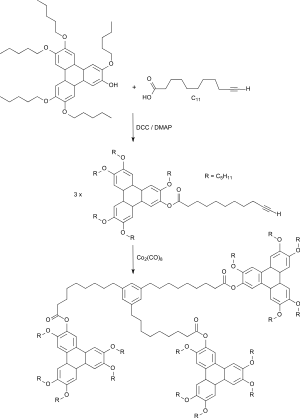
Langkettig substituierte scheibenförmige Mesogene als Grundkörper kolumnarer Flüssigkristallphasen lassen sich in einer Steglich-Veresterung mit Dicyclohexylcarbodiimid/4-(Dimethylamino)pyridin von 10-Undecinsäure mit einer Hydroxytriphenylen-Verbindung gewinnen.[6] Aus dem erhaltenen Ester kann durch eine mit Dicobaltoctacarbonyl-katalysierte [2+2+2]-Cycloaddition ein sternförmiges Trimer gebildet werden, das interessante flüssigkristalline Eigenschaften aufweist.
10-Undecinsäure kann als Anker für funktionelle Moleküle an Kohlenhydrate, wie z. B. Stärke dienen.[15] Die durch Lipolase katalysierte enzymatische Veresterung liefert Stärke-10-undecinoat, an dessen terminale Ethinylgruppe über eine Cu(I)-katalysierte Azid/Alkin-Cycloaddition (s. auch Click-Chemie) azidfunktionalisierte Fluoreszenzlabel oder azidderivatisiertes Biotin gebunden werden, das markiertes Streptavidin zu binden vermag.
10-Undecinsäure ist Ausgangsmaterial für Pheromon-Synthesen, z. B. dem Insektenlockstoff Dodec-10E-enylacetat.[16]
Einzelnachweise
- N.A. Khan: 10-undecynoic acid In: Organic Syntheses. 32, 1952, S. 104, doi:10.15227/orgsyn.032.0104; Coll. Vol. 4, 1963, S. 969 (PDF).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. Elsevier, 2008, ISBN 978-0-8155-1596-8, S. 315.
- Datenblatt 10-Undecynoic acid bei Sigma-Aldrich, abgerufen am 20. Oktober 2014 (PDF).
- Datenblatt 10-Undecynoic acid, 96% bei AlfaAesar, abgerufen am 25. Oktober 2014 (PDF) (JavaScript erforderlich).
- Patent WO2007138345: Process for producing stabilised metal nanoparticles. Angemeldet am 22. Mai 2007, veröffentlicht am 6. Dezember 2007, Anmelder: Johnson Matthey Plc., Erfinder: P.T. Bishop, A. Boardman.
- B. Han, P. Hu, B.-Q. Wang, C. Redshaw, K.Q. Zhao: Triphenylene discotic liquid crystal trimers synthsized by Co2(CO)8-catalyzed terminal alkyne [2+2+2] cycloaddition. In: Beilstein J. Org. Chem. Band 9, 2013, S. 2852–2861, doi:10.3762/bjoc.9.321.
- L. Brandsma: Preparative Acetylenic Chemistry. In: Studies in Organic Chemistry 34. Elsevier, 1988, ISBN 0-444-42960-3, S. 173–174.
- D. Villemin, P. Cadiot, M. Kuetegan: A new synthesis of ω-hydroxyalkanoic acids via copper catalysis. In: Synthesis. 1984, ISSN 0039-7881, S. 230–231.
- S. Narasimhan, H. Mohan, N. Palani: An improved procedure for the synthesis of terminal and internal alkynes from 10-undecenoic acid. In: Synth. Commun. Band 21, Nr. 18-19, 1991, S. 1941–1949, doi:10.1080/00397919108021786.
- Santa Cruz Biotechnology, Inc.: 10-Undecynoic acid
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: EU-Pestiziddatenbank; Eintrag im nationalen Pflanzenschutzmittelverzeichnis der Schweiz, abgerufen am 25. Juni 2016.
- R.J. González-Paz, G. Lligadas, J.C. Ronda, M. Galià, V. Cádiz: Thiol-yne reaction of alkyne-derivatized fatty acids: biobased polyols and cytocompatibility of derived polyurethanes. In: Polym. Chem. Band 3, 2012, S. 2471–2478, doi:10.1039/C2PY20273E.
- G. Lligadas, J.C. Ronda, M. Galia, V. Cadiz: Polyurethane networks from fatty acid-based aromatic triols: synthesis, and characterization. In: Biomolecules. Band 8, 2007, S. 1858–1864, doi:10.1021/bm070157k.
- Patent US3420859: 11-Iodo-10-undecynoic acid and ist derivatives. Angemeldet am 9. März 1965, veröffentlicht am 7. Januar 1969, Anmelder: Kaken K.K., Erfinder: A. Ueno, E. Matsuzaki, Y. Momoki, Y. Ishimaru, G. Saito, S. Sakai.
- A. Alissandratos, N. Baudendistel, B. Hauer, K. Baldenius, S. Flitsch, P. Halling: Biocompatible functionalization of starch. In: Chem. Commun. Band 47, 2010, S. 683–685, doi:10.1039/C0CC02908D.
- R.I. Ishchenko, B.G. Kovalev, N.B. Kalyuzhnaya: Synthesis of dodec-10E-enylacetate – the sex pheromone of Phyllonorycter blancardella (Lepidoptera: Gracillariidae). In: Chemistry of Natural Compounds. Band 32, Nr. 1, 1996, S. 77–79, doi:10.1007/BF01373798.
