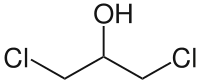
1,3-Dichlor-2-propanol
1,3-Dichlor-2-propanol (1,3-DCP) ist eine chemische Verbindung aus der Gruppe der Alkohole und Chlorverbindungen und eine wichtige Zwischenstufe in der Synthese der High Production Volume Chemical Epichlorhydrin. Wegen seiner industriellen Bedeutung wurde die Verbindung toxikologisch intensiv untersucht.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Dichlor-2-propanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6Cl2O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,99 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,39 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
175 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (110 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,4835 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−385,3 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
1,3-DCP entsteht bei der Einwirkung von Chloridionen auf Lipidbestandteile von Lebensmitteln bei unterschiedlichen Bedingungen, wie bei der Zubereitung, beim Kochen und bei der Lagerung.[6]
Der Säurehydrolyseprozess, den viele Hersteller von Sojasaucen verwenden, führt neben der Entstehung von 3-Chlor-1,2-propandiol (3-MCPD) immer auch zu 1,3-Dichlor-2-propanol. Für 3-MCPD wurde vom Bundesinstitut für Risikobewertung (BfR) einen Grenzwert in Lebensmitteln festgelegt, nicht aber für 1,3-DCP. Nach Aussage einiger Wissenschaftler soll 1,3-DCP Krebs auslösen können. Dieser kann in betroffenen Geschlechtszellen an nachfolgende Generationen, die niemals der Chemikalie ausgesetzt waren, weitergegeben werden.[7]
Außer in Sojasaucen wurde 1,3-DCP auch in säurebehandelten Pflanzenproteinzubereitungen, sowie in einer Vielzahl von Fisch- und Fleischerzeugnissen gefunden.[6]
Gewinnung und Darstellung
In einer frühen Veröffentlichung[8] wird Glycerin mit Dischwefeldichlorid in 62%iger Ausbeute zum 1,3-Dichlor-2-propanol umgesetzt.

Der Prozess ist wegen der unangenehmen Eigenschaften von S2Cl2 nur von historischem Interesse.
Für eine praktische Umsetzung eignet sich eine Patentschrift aus dem Jahr 1912.[9]
Für ein großtechnisches industrielles Verfahren eignet sich aber nur eine kontinuierliche Prozessführung.[10] Hierbei wird die Hydrochlorierung von Glycerin statt mit Essigsäure mit Adipinsäure als Katalysator bei 130 °C durchgeführt und bei praktisch vollständigem Glycerin- und HCl-Gasumsatz in einer Gesamtausbeute von 93 % überwiegend 1,3-Dichlor-2-propanol neben ca. 3 % 2,3-Dichlorpropan-1-ol erhalten.
Die Umsetzung (Veresterung) von Glycerin mit Chlorwasserstoff in Gegenwart einer organischen Säure als Katalysator umfasst mehrere Gleichgewichtsreaktionen, wie z. B. Monochlorierung, Dichlorierung, Etherbildung zum Diglycerin, Chlorierung von Diglycerin, Esterbildung mit dem Säurekatalysator usw.[10][11], die Ausbeuteverluste an 1,3-DCP bei nicht optimierten Prozessen verursachen.
Eigenschaften
1,3-Dichlor-2-propanol ist eine farblose, schwer entzündbare Flüssigkeit mit phenolartigem Geruch, die leicht löslich in Wasser ist. Sie zersetzt sich bei Erhitzung, wobei Chlorwasserstoff und Phosgen entstehen können.[1]
Verwendung
1,3-DCP findet wegen seiner toxikologischen Eigenschaften keine Verwendung mehr als Lösungsmittel und zur Textilveredelung.
Das in den USA als Nematizid zur Bodenbehandlung (englisch soil fumigant) verwendete 1,3-Dichlorpropen ist aus 1,3-Dichlor-2-propanol durch Wasserabspaltung zugänglich.
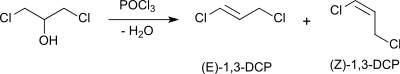
Das mutagene 1,2,3-Trichlorpropan entsteht beim Austausch auch der sekundären Hydroxygruppe in 1,3-Dichlor-2-propanol durch HCl.
Mit dem rasanten Anstieg preisgünstiger Mengen von Glycerin aus der Biodiesel-Produktion in den 1990er-Jahren wurde 1,3-Dichlor-2-propanol als Zwischenstufe zu „Bio-Epichlorhydrin“ (engl. glycerol-to-epichlorohydrin GTE) wieder interessant.[12][13]
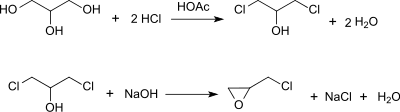
Die optimierten Verfahren, wie u. a. in[10] beschrieben und z. B. als Epicerol®-Technologie (Solvay) oder GTE process (DOW) kommerzialisiert, wurden in mehreren Großanlagen (>100,000 jato Kapazität) in Asien umgesetzt und sollen eine um 60 % geringere CO2-Bilanz (engl. carbon footprint) als der petrochemische Prozess über Allylchlorid haben.[14]
Sicherheitshinweise
Bei einer akuten Vergiftung tritt eine starke Reizung der Schleimhäute, insbesondere der Augen auf. Weiterhin sind gastrointestinale Störungen, eine Leberschädigung und Nierenfunktionsstörungen möglich. Der Stoff sollte als kanzerogen für den Menschen angesehen werden. In einer Trinkwasserstudie über 102 Wochen an Ratten fand man in den höchsten Dosisgruppen (bis 30 mg/kg Körpergewicht) erhöhte und in den beiden anderen Dosisgruppen leicht bzw. nicht erhöhte Inzidenzen an malignen Neubildungen verschiedener Lokalisation (Leber, Niere, Zunge, Mundhöhle, Schilddrüse).[1]
Einzelnachweise
- Eintrag zu 1,3-Dichlor-2-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt 1,3-Dichlor-2-propanol (PDF) bei Merck, abgerufen am 24. April 2012.
- Eintrag zu 1,3-dichloropropan-2-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- National Toxicology Program (NTP): 1,3-Dichloro-2-propanol, [CAS No. 96-23-1]. Review of Toxicological Literature. Januar 2005.
- G. Williams, J.-C. Leblanc, R.W. Setzer: Application of the margin of exposure (MoE) approach to substances in food that are genotoxic and carcinogenic Example: (CAS No. 96-23-1) 1,3-Dichloro-2-propanol (DCP). In: Food Chem. Toxicol. Band 48, 2010, S. S57–S62, doi:10.1016/j.fct.2009.10.038.
- Junelyn S. de la Rosa: Is your soy sauce safe? In: Bureau of Agricultural Research Chronicle. Band 5, Nr. 5, Mai 2004, S. 1–31 (gov.ph).
- A. Claus: IV. Ueber die Darstellung des Dichlorhydrins. In: Justus Liebigs Ann. Chem. Band 168, Nr. 1, 1873, S. 44–44, doi:10.1002/jlac.18731680105.
- Patent DE197308: Verfahren zur Darstellung von Mono- und Dichlorhydrin aus Glycerin und gasförmiger Salzsäure. Angemeldet am 20. November 1906, veröffentlicht am 16. April 1908, Anmelder: C.F. Boehringer & Söhne.
- Patent EP1760060A1: Process for preparing dichloropropanol from glycerol. Angemeldet am 18. November 2004, veröffentlicht am 7. März 2007, Anmelder: Solvay S.A., Erfinder: P. Krafft, P. Gilbeau, B. Gosselin, S. Claessens.
- A. Almena, M. Martin: Technoeconomic analysis of the production of epichlorohydrin from glycerol. In: Ind. Eng. Chem. Res. Band 55, Nr. 12, 2016, S. 3226–3238, doi:10.1021/acs.iecr.5b02555.
- M. Pagliano, M. Rossi: The future of glycerol: New usages for a versatile raw material. RSC Green Chemistry Series, Cambridge 2008, ISBN 978-1-84973-046-4, S. 47–53.
- B.M. Bell et al.: Glycerin as a renewable feedstock for epichlorohydrin production. The GTE process. In: CLEAN – Soil, Air, Water. Band 36, Nr. 8, 2008, S. 657–661, doi:10.1002/clen.200800067.
- Guy-Noël Sauvion: Process Innovation focused on Sustainable Chemistry (Memento vom 16. April 2016 im Internet Archive). ISGC, 6. Mai 2015, La Rochelle.

