1,1-Difluorethan
1,1-Difluorethan ist eine chemische Verbindung aus der Gruppe der Fluorkohlenwasserstoffe. Unter den Bezeichnungen R152a und HFC-152a wird der Stoff vorwiegend als Kältemittel eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
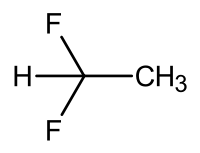 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,1-Difluorethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C2H4F2 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit schwach süßlichem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 66,05 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−24,9 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (3,2 g·l−1 bei 25 °C)[4] | |||||||||||||||
| Brechungsindex |
1,3011 (−72 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Treibhauspotential |
167 (bezogen auf 100 Jahre)[8] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−497,0 kJ/mol[9] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
1,1-Difluorethan kann durch eine Quecksilber katalysierte Addition von Fluorwasserstoff an Ethin gewonnen werden:[10]
Die Gasphasenhydrierung von 1,1-Dichlor-2,2-difluorethen oder 1-Chlor-2,2-difluorethen ergibt ebenfalls 1,1-Difluorethan.[11]
Eine weitere Darstellungsmethode ist die Addition von Fluor an Ethen mittels Xenondifluorid, wobei allerdings ein Produktgemisch aus 45 % 1,2-Difluorethan, 35 % 1,1-Difluorethan und 20 % 1,1,2-Trifluorethan entsteht.[12][13]
Eigenschaften
1,1-Difluorethan ist ein farbloses Gas, das bei Normaldruck bei −25 °C siedet.[2] Die molare Verdampfungsenthalpie beträgt am Siedepunkt 22,7 kJ·mol−1.[14] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend
im Temperaturbereich von 160,7 K bis 246,7 K.[15] Festes 1,1-Difluorethan schmilzt bei −118,55 °C mit einer molaren Schmelzenthalpie von 1,57 kJ·mol−1.[16] Der Tripelpunkt liegt bei −118,59 °C und 0,6 mbar.[17][18] Als kritische Daten sind die kritische Temperatur mit Tc = 113,5 °C, der kritische Druck mit pc = 44,9 bar und eine kritische Dichte mit σc = 0,365 g·cm−3 bekannt.[2][19] Die Verbindung ist mit einem Dipolmoment von 2,27 D stark polar,[3] was eine Wasserlöslichkeit von 3,2 g/l bei 25 °C verursacht.[4]
1,1-Difluorethan bildet entzündliche Gas-Luft-Gemische. Der Explosionsbereich liegt zwischen 4 Vol% (112 g/m3) als untere Explosionsgrenze (UEG) und 18,5 Vol% (518 g/m3) als obere Explosionsgrenze (OEG).[2][19][20] Die Zündtemperatur beträgt 455 °C.[2][20] Der Stoff fällt somit in die Temperaturklasse T1.
Sicherheitshinweise
Im Tierversuch war das Gas bei Ratten und Mäusen erst bei extrem hohen Dosen giftig. Es wirkte bei Ratten narkotisierend, erzeugte Schläfrigkeit und allgemein gedämpftes Verhalten.[6]
Einzelnachweise
- Eintrag zu HYDROFLUOROCARBON 152A in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu 1,1-Difluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Mai 2019. (JavaScript erforderlich)
- D. R. Lide: Handbook of Organic Solvents. S. 160, CRC Press, 1995, ISBN 978-0-8493-8930-6.
- Eintrag zu 1,1-Difluoroethane in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-172.
- National Technical Information Service. OTS0530083.
- Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure, Izmerov, N. F., et al., Moscow, Centre of International Projects, GKNT, 1982, Pg. 54, 1982.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick: Fluorine Compounds, Organic. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a11_349
- Lacher, J.R.; Kianpour, A.; Oetting, F.; Park, J.D.: Reaction calorimetry. The hydrogenation of organic fluorides and chlorides in Trans. Faraday Soc. 52 (1956) 1500–1508, doi:10.1039/TF9565201500.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Xenon(II)-fluorid, abgerufen am 20. Januar 2018.
- Yang,N.-C.; Shieh, T.-C.; Feit, E.D.; Chernick, C.L.: Reactions of xenon fluorides with organic compounds in J. Org. Chem. 35 (1970) 4020–4024, doi:10.1021/jo00837a001.
- Kul, I.; DesMarteau, D.D.; Beyerlein, A.L.: Vapor--liquid equilibria for CF3OCF2H/fluorinated ethane and CF3SF5/fluorinated ethane mixtures as potential R22 alternatives in Fluid Phase Equilibria 185 (2001) 241–253, doi:10.1016/S0378-3812(01)00474-5.
- D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. Band 39, 1947, S. 517–540., doi:10.1021/ie50448a022
- Magee, J.W.: Molar Heat Capacity at Constant Volume of 1,1-Difluoroethane (R152a) and 1,1,1-Trifluoroethane (R143a) from the Triple-Point Temperature to 345 K at Pressures to 35 MPa in International Journal of Thermophysics 19 (1998) 1397–1420, doi:10.1023/A:1021983502589.
- Blanke, W.; Weiss, R.: Isochoric (p,v,T) measurements on 1,1-difluoroethane (R152a) in the liquid state from the triple point to 450 K and at pressures up to 30 MPa in Fluid Phase Equilib. 80 (1992) 179–190, doi:10.1016/0378-3812(92)87066-V.
- Blanke, W.; Weiss, R.: Thermodynamic properties of refrigerants. Part I: the triple points of the refrigerants R11, R12, R22, R142b, and 152a in PTB-Mitt. 101 (1991) 337–339.
- Chemsafe Datenbank für sicherheitstechnische Kenngrößen im Explosionsschutz, PTB Braunschweig/BAM Berlin, abgerufen am 21. Mai 2019.
- E. Brandes, W. Möller: Sicherheitstechnische Kenndaten – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.

