Virophagen
Als Virophagen (Singular: Virophage, der; von lat. virus, -i, n. „Gift, Saft, Schleim“ und altgriechisch φαγεῖν phageín, „fressen“) bezeichnet man eine Gruppe von Viren, die auf die Nutzung von Genen anderer Viren (sogenannter „Helferviren“ – hier auch „Mamaviren“ genannt) während der gemeinsamen Infektion einer Wirtszelle angewiesen sind. Dabei werden Genprodukte des Helfervirus genutzt, die sonst nur bei eukaryonten Zellen die Proteinsynthese ermöglichen. Die Proteinsynthese des „Mamavirus“ wird dabei jedoch beeinträchtigt.[1][2] Insofern vermehren sich Virophagen nicht „in“ anderen Viren, sondern mit dem Syntheseapparat des anderen Virus und treten dadurch in eine Konkurrenz zu ihnen.[3][4] Virophagen sind daher parasitäre Satellitenviren. Die von den Erstbeschreibern vorgeschlagene Bezeichnung „Virophage“ („Viren-Esser“) in begrifflicher Anlehnung an die Virengruppe der Bakteriophagen, die zur Vermehrung auf die Infektion von Bakterien und Archaeen als Wirtszellen spezialisiert sind, könnte daher irreführend sein und wird in der Virologie derzeit diskutiert.
In der Funktionsweise ähnlich sind DIVs („Defektive interferierende Viren“, englisch defective interfering viruses, auch defective interfering particles, DIPs). Dies sind natürlich entstandene oder künstlich erzeugte defektive Abarten eines Virus-Wildtyps, die den Wildtyp als Helfervirus benötigen und wie Parasiten dessen Replikation stören können.[5]
Forschungsgeschichte
Der erste Virophage namens Sputnik wurde im Jahr 2008 von Bernard La Scola und Didier Raoult von der Université de la Méditerranée in Marseille in den Rohren eines Kühlwassersystems in Paris entdeckt. Er parasitiert das Acanthamoeba castellanii mamavirus:[2] Einen Überblick über die Virophagen geben Zhou et al. (2013)[7] und Gong et al. (2016)[8] sowie Chen et al. (2018):[9]
- vom International Committee on Taxonomy of Viruses (ICTV) mit Stand März 2019 bestätigt:
- Gattung Sputnikvirus mit Spezies Sputnik-Virus und Zamilon-Virus, parasitieren Mimiviridae der Gruppe I
- Gattung Mavirus mit Spezies Cafeteriavirus-dependent-Mavirus, parasitiert Cafeteria-roenbergensis-Virus (CroV, Mimiviridae-Gruppe II)
- bis dato nur vorgeschlagene Vertreter:[8]
- Guarani Virophage[10][11][12]
- Ace-Lake-Mavirus (ALM), zur Gattung Mavirus (siehe Ace Lake)
- Dishui-Lake-Virophage 1 (DSLV1), parasitiert vermutlich Phycodnaviridae (siehe Dishui Lake)
- Organic-Lake-Virophage (OLV), parasitiert Organic Lake Phycodnavirus (OLPV) (siehe Organic Lake)
- Qinghai-Lake-Virophage (QLV)[13] (siehe Qinghai-See)
- Yellowstone-Lake-Virophage 1 bis 7 (YSLV1 bis YSLV7), zu unterscheiden von ihren mutmaßlichen Wirten Yellowstone Lake Phycodnavirus (YSLPV) alias Yellowstone Lake Mimivirus (Yellowstone Lake Giant Virus, YSLGV)[14][15] (siehe Yellowstone Lake)
- Phaeocystis globosa Virus Virophage (PgVV), parasitiert Phaeocystis globosa virus (PgV)[6][16][17]
- Platanovirus saccamoebae virophage (alias Comedo Virophage bzw. Comedo virus), parasitiert Platanovirus saccamoebae KSL5[6][12]
- Sissivirophage, parasitiert Sissivirus[11]
- Lake Mendota Virophage Candidate Genus 1 bis 3 sowie weitere Spezies, über deren Fund im Lake Mendota, Wisconsin 2017 von Roux et al. berichtet wurde.[18]
- TBE Virophages (TBE: englisch Trout Bog epilimnion) und TBH Virophages (TBH: engl. Trout Bog hypolimnion) sind eine Klassifizierung für eine Reihen von Viophagen, die in den Oberfläschenchichten (Epilimnion) bzw. in den Tiefen (Hypolimnion) des Moorsees Trout Bog Lake, Wisconsin, gefunden wurden (Roux et al., 2017).[18]
- Sheep Rumen hybrid virophage (SRHV)[18] / Rumen Virophages (RVPs)[19]
- Rio Negro Virophage (RNV), parasitiert Sambavirus[6][12]
- Cryoconite virophage, Grönland (Gletscher)[20]
- Chrysochromulina parva virophage (Süßwasser, USA)[20]
- Loki’s Castle virophages (virophage contig 852 und 1368), Sputnik-like, vom Schwarzen Raucher Lokis Schloss[21]
- Tetraselmis striata virus (alias „Tetraselmis viridis virus S1“, marin, Polinton-like virus: möglicher Virophage. Accession number NC_020869.1)[20][22][23]
Weitere Gensequenzen von Virophagen hat man unter anderem auch an folgenden Stellen gefunden:
- Punta Cormorant, eine salzige Lagune auf Floreana#Pflanzen- und Tierwelt (Santa María, englisch Charles, Galápagos-Inseln)[4][24][3]
- Einem Ocean Upwelling auf Fernandina (englisch Narborough Island, ebenfalls Galápagos-Inseln)[4][24][3]
- Delaware Bay Ästuar (New Jersey, Ostküste der USA)[4][24][3]
- Gatúnsee (englisch Lake Gatun, ein Süßwassersee in Panama, Mittelamerika)
- Gossenköllesee (Österreich)[20]
Lavidaviridae
Die Virophagen der Riesenviren sind im Vergleich zu Satellitenviren anderer Helferviren ebenfalls vergleichsweise riesig und haben auch ein komplexeres Genom.[16]
Systematik
| Lavidaviridae | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Lavidaviridae | ||||||||||||||
| Links | ||||||||||||||
|
- Familie Lavidaviridae[26][27]
- Gattung Sputnikvirus mit den beiden Spezies Sputnik (Mimivirus-dependent virus Sputnik) und Zamilon (Mimivirus-dependent virus Zamilon), sowie den Kandidaten „Sputnik 2“, „3“ und „Zamilon 2“.[16]
- Gattung Mavirus mit Cafeteriavirus-dependent mavirus und (mit Stand März 2019 vom ICTV unbestätigt) „ALM“, sowie „YSLV7“ und evtl. den „RVPs“
- Gattung „Lake Mendota Virophage Candidate Genus 1“ (vorgeschlagen) mit „DSLV1“, „YSLV3“ und „Mendota 1002791“[18]
- Gattung „Lake Mendota Virophage Candidate Genus 2“ (vorgeschlagen) mit „Mendota 2320000189“ und „Mendota 2367002401“[18]
- Gattung „Lake Mendota Virophage Candidate Genus 3“ (vorgeschlagen) mit „Mendota 157001142“ und „Mendota 2256000135“[18]
- keiner Gattung (offiziell oder per Vorschlag) zugeordnet sind bis auf Weiteres „YSLV1“, „YSLV2“, „YSLV4“, „YSLV5“, „YSLV6“, „QLV“, „OLV“, „PgVV“, „RNV“, „SRHV“ mit den „RVPs“, „Platanovirus saccamoebae virophage“, die „TBH“- und „TBE“-Virophagen, weitere Lake-Mendota-Virophagen …
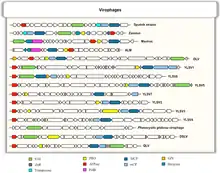 Vergleich von konservierten Genarchitekturen in den Genomen von Virophagen.[16]
Vergleich von konservierten Genarchitekturen in den Genomen von Virophagen.[16]
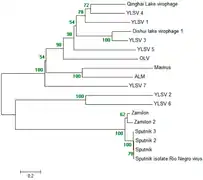
Die phylogenetischen Beziehungen der obigen Vertreter und Kandidaten sind noch in Diskussion. Weitere Vorschläge für Systematiken finden sich beispielsweise bei:
Replikationszyklus
Die Virophagen der Lavidaviridae infizieren nur Riesenviren aus dem Phylum der Nucleocytoviricota (NCLDV) und sind auch selbst im Vergleich zu anderen Satellitenviren sehr groß. Normalerweise initiieren Satellitenviren die Expression und Replikation ihres Genoms im Zellkern der Wirtszelle mit Hilfe ihrer dortigen Maschinerie und geht dann in das Zytoplasma. Dort findet es die Morphogenese-Maschinerie seines Helfervirus, mit der dieses seine Virionen (Virusteilchen) zusammenbaut (Assembly). Diese wird vom Satellitenvirus gekapert, um seine eigenen Nachkommen zu produzieren.
Bei den Virophagen der Familie Lavidaviridae wird angenommen, dass die Replikation der Virophagen vollständig in der Virusfabrik des Riesenvirus-Wirts stattfindet und daher vom Expressions- und Replikationskomplex des Riesenvirus abhängt.[6] Wenn die Wirtszelle nur von einem Riesenvirus infiziert wird, baut dieser eine im Zytoplasma eine Virusfabrik (VF) auf, um sich zu replizieren und neue Virionen zu erzeugen. Die Wirtszelle wird am Ende seines Replikationszyklus gewöhnlich lysiert, d. h. unter Freisetzung der Virus-Nachkommenschaft zum Platzen gebracht und so zerstört – Abbildung Teil (A), links.
Wenn die Wirtszelle mit einem Riesenvirus und einem Virophagen koinfiziert ist, parasitiert letzterer in der dieser Virusfabrik des Riesenvirus. Die Anwesenheit von Virophagen kann die Infektiosität des Riesenvirus daher ernsthaft beeinträchtigen, indem sie seine Replikationseffizienz verringert und damit indirekt das Überleben der Wirtszelle erhöht – Abbildung Teil (B), mittig.
Ein Sonderfall ist, wenn das Genom des Riesenvirus von einem Provirophagen parasitiert wird. Dies ist ein Virophage, der sich in das Genom seines Helfervirus integriert hat – man beachte, dass sowohl die Virophagen (als Mitglieder der Lavidaviridae), als auch die Helferviren (als Riesenviren Mitglieder der Nucleocytoviricota) dsDNA-Viren sind. Der Provirophage wird während der Replikation des Riesenvirus exprimiert. Der Virophage wird dann in der Virusfabrik des Riesenvirus produziert und hemmt die Replikation des Riesenvirus, wodurch wieder das Überleben der Wirtszelle erhöht wird – Abbildung Teil (C), rechts.[6]
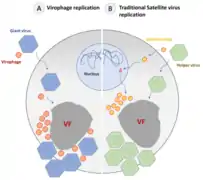 Reproduktionszyklus nach Mougari, Sahmi-Bounsiar et al. (2019):[6][Anm. 1]
Reproduktionszyklus nach Mougari, Sahmi-Bounsiar et al. (2019):[6][Anm. 1]
(B, rechts) – eines herkömmlichen Satellitenvirus und
(A, links) – eines Virophagen der Lavidaviridae der ein Riesenvirus der Nucleocytoviricota (NCLDV) parasitiert.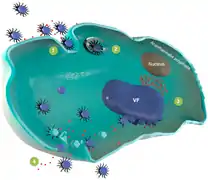 Der intrazelluläre Replikationszyklus von Virophagen.[16]
Der intrazelluläre Replikationszyklus von Virophagen.[16]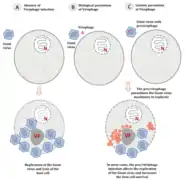
Weblinks
- Christelle Desnues, Bernard La Scola, Natalya Yutin, Ghislain Fournous, Catherine Robert, Saïd Azza, Priscilla Jardot, Sonia Monteil, Angélique Campocasso, Eugene V. Koonin Didier Raoult: Provirophages and transpovirons as the diverse mobilome of giant viruses. In: PNAS. Band 109, Nr. 44, 30. Oktober 2012, S. 18078–18083, doi:10.1073/pnas.1208835109.
- Graziele Oliveira, Bernard La Scola, Jônatas Abrahão: Giant virus vs amoeba: fight for supremacy. In: Virology Journal. Band 16, Nr. 1, Artikel 126, veröffentlicht: 4. November 2019, doi:10.1186/s12985-019-1244-3 (Volltext als PDF Auf: researchgate.net).
- Laurie O'Keefe: Sizing Up Viruses. In: The Scientist. (Volltext als PDF Auf: cdn.the-scientist.com) Illustration zu Didier Raoult: Viruses Reconsidered. In: The Scientist. 28. Februar 2014: Grafische Darstellung der Größenverhältnisse (Volltext Auf: the-scientist.com).
- David Paez-Espino, Jinglie Zhou, Simon Roux, et al.: Diversity, evolution, and classification of virophages uncovered through global metagenomics. In: Microbiome. Band 7, Nr. 157, 10. Dezember 2019, doi:10.1186/s40168-019-0768-5.
Anmerkungen
- Das Material wurde von dieser Quelle kopiert, die unter einer Creative Commons Attribution 4.0 International License verfügbar ist.
Einzelnachweise
- Max-Planck-Institut für biophysikalische Chemie: Archiv Biologie: Sind Viren Lebewesen?
- La Scola et al.: The virophage as a unique parasite of the giant mimivirus. In: Nature. Band 455, 4. September 2008, S. 100–105, doi:10.1038/nature07218.
- Jan Osterkamp: Freundliche Feinde des Feindes. Auf: spektrum.de – News vom 31. März 2011; zuletzt abgerufen am 29. Juli 2019.
- Sheree Yau, Federico M. Lauro, Matthew Z. DeMaere, Mark V. Brown et al.: Virophage control of antarctic algal host–virus dynamics. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 15, 12. April 2011 (online 28. März 2011), S. 6163–6168, doi:10.1073/pnas.1018221108, PMC 3076838 (freier Volltext), PMID 21444812.
- Fighting COVID With COVID: Driving the Disease to Extinction With a Defective Version of the SARS-CoV-2 Virus. Auf: scitechdaily.com vom 20. August 2021.
- Said Mougari, Dehia Sahmi-Bounsiar, Anthony Levasseur, Philippe Colson, Bernard La Scola: Virophages of Giant Viruses: An Update at Eleven. In: Viruses. Band 11, Nr. 8, 2019, ISSN 1999-4915, S. 733, doi:10.3390/v11080733, PMID 31398856, PMC 6723459 (freier Volltext).
- Jinglie Zhou, Weijia Zhang, Shuling Yan et al.: Diversity of Virophages in Metagenomic Data Sets. In: Journal of Virology. Band 87, Nr. 8, Februar 2013, S. 4225–4236, doi:10.1128/JVI.03398-12, PMID 23408616.
- Chaowen Gong, Weijia Zhang, Xuewen Zhou, Hongming Wang et al.: Novel Virophages Discovered in a Freshwater Lake in China. In: Frontiers in Microbiology. Band 7, 22. Januar 2016, ISSN 1664-302X, doi:10.3389/fmicb.2016.00005, PMID 26834726.
- Hao Chen, Weijia Zhang, Xiefei Li, Yingjie Pan, Shuling Yan, Yongjie Wang: The genome of a prasinoviruses-related freshwater virus reveals unusual diversity of phycodnaviruses. In: BMC Genomics. Band 19, Nr. 49, 15. Januar 2018, ISSN 1471-2164, doi:10.1186/s12864-018-4432-4, PMID 29334892, PMC 5769502 (freier Volltext). – Achtung: OLV ist hier Abkürzung für Organic Lake Virophage, OlV für Ostreococcus lucimarinus virus (Gattung Prasinovirus).
- NCBI: Guarani virophage. (species) Auf: ncbi.nlm.nih.gov; zuletzt abgerufen am 22. März 2021.
- Clara Rolland, Julien Andreani, Amina Cherif Louazani, Sarah Aherfi et al.: Discovery and Further Studies on Giant Viruses at the IHU Mediterranee Infection That Modified the Perception of the Virosphere. In: Viruses. Band 11, 4 (März/April), 2019, ISSN 1999-4915, S. 312, doi:10.3390/v11040312, PMID 30935049, PMC 6520786 (freier Volltext).
- Said Mougari, Meriem Bekliz, Jonatas Abrahao, Fabrizio Di Pinto, Anthony Levasseur, Bernard La Scola: Guarani Virophage, a New Sputnik-Like Isolate From a Brazilian Lake. In: Frontiers in Microbiology. Band 10, 3. Mai 2019, ISSN 1664-302X, doi:10.3389/fmicb.2019.01003, PMID 31130943, PMC 6510173 (freier Volltext). – (Volltext als PDF Auf: semanticscholar.orgPDF)
- Seungdae Oh, Dongwan Yoo, Wen-Tso Liu: Metagenomics Reveals a Novel Virophage Population in a Tibetan Mountain Lake. In: Microbes and Environments. Band 31, Nr. 2, Juni 2016, ISSN 1342-6311, S. 173–177, doi:10.1264/jsme2.ME16003, PMID 27151658, PMC 4912154 (freier Volltext).
- Weijia Zhang, Jinglie Zhou, Taigang Liu, Yongxin Yu et al.: Four novel algal virus genomes discovered from Yellowstone Lake metagenomes. In: Scientific Reports. Band 5, Nr. 1, 2015, ISSN 2045-2322, S. 15131, doi:10.1038/srep15131, PMID 26459929 (Figur 6).
- Virus-Host DB: Yellowstone lake mimivirus. Auf: genome.jp; zuletzt abgerufen am 22. März 2021.
- Meriem Bekliz, Philippe Colson, Bernard La Scola: The Expanding Family of Virophages. In: MDPI Viruses. Band 8, Nr. 11 (Special Issue Viruses of Protozoa), 23. November 2016, S. 317, doi:10.3390/v8110317.
- NCBI: Phaeocystis globosa virus virophage. (species) Auf: ncbi.nlm.nih.gov; zuletzt abgerufen am 22. März 2021.
- Simon Roux, Leong-Keat Chan, Rob Egan et al.: Ecogenomics of virophages and their giant virus hosts assessed through time series metagenomics. In: Nature Communications. Band 8, Nr. 858, 11. Oktober 2017, doi:10.1038/s41467-017-01086-2, PMID 29021524, PMC 5636890 (freier Volltext). – (OSTI: DOE Pages Auf: osti.gov Office of Scientific and Technical Information Energieministerium der Vereinigten Staaten, Volltext als PDF Auf: nature.com).
- Natalya Yutin, Vladimir V. Kapitonov, Eugene V. Koonin: A new family of hybrid virophages from an animal gut metagenome. In: Biology Direct. Band 10, Nr. 19, 25. April 2015, ISSN 1745-6150, doi:10.1186/s13062-015-0054-9, PMID 25909276, PMC 4409740 (freier Volltext).
- Christopher M. Bellas, Ruben Sommaruga: Polinton-like viruses are abundant in aquatic ecosystems. In: Microbiome. Band 9, Nr. 13, 12. Januar 2021, doi:10.1186/s40168-020-00956-0.
- Disa Bäckström, Natalya Yutin, Steffen L. Jørgensen, Jennah Dharamshi, Felix Homa, Katarzyna Zaremba-Niedwiedzka, Anja Spang, Yuri I. Wolf, Eugene V. Koonin, Thijs J. G. Ettema: Virus Genomes from Deep Sea Sediments Expand the Ocean Megavirome and Support Independent Origins of Viral Gigantism. In: mBio. Band 10, Nr. 2, 2019, ISSN 2150-7511, doi:10.1128/mBio.02497-18, PMID 30837339.
- NCBI: Tetraselmis viridis virus S1 (species), NC_020869.1
- Darius Kazlauskas, Mart Krupovic, Česlovas Venclovas: The logic of DNA replication in double-stranded DNA viruses: insights from global analysis of viral genomes. In: Nucleic Acids Research. Band 44, Nr. 10, 2. Juni 2016, S. 4551–4564, doi:10.1093/nar/gkw322.
- Meriem Bekliz, Jonathan Verneau, Samia Benamar et al.: A New Zamilon-like Virophage Partial Genome Assembled from a Bioreactor Metagenome. In: Frontiers in Microbiology. Band 6, 27. November 2015, ISSN 1664-302X, doi:10.3389/fmicb.2015.01308, PMID 26640459.
- ICTV: ICTV Master Species List 2019.v1. New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35) Auf: talk.ictvonline.org; zuletzt abgerufen am 22. März 2021.
- englisch large virus-dependent or -associated viruses
- NCBI: Lavidaviridae. (family) Auf: ncbi.nlm.nih.gov; zuletzt abgerufen am 22. März 2021.
- Mart Krupovic, Jens H. Kuhn, Matthias G. Fischer: A classification system for virophages and satellite viruses. In: Archives of Virology. Band 161, Nr. 1, Januar 2016, ISSN 1432-8798, S. 233–247, doi:10.1007/s00705-015-2622-9.

_Guarani%2540Mimivirus.png.webp)
_Guarani_progeny.png.webp)