Viroid
Viroide sind die kleinsten bekannten infektiösen subzellulären Erreger mit Genom,[1] 80 bis 100-fach kleiner als die kleinsten Viren[2], besitzen aber im Gegensatz zu ihnen weder ein Kapsid noch eine Virushülle. Sie zählen nicht zu den Lebewesen (Organismen), da sie keinen eigenen Stoffwechsel haben und sich nur innerhalb lebender Zellen vermehren können. Viroide besitzen allgemein die Fähigkeit, ihre Replikation zu steuern, und die Fähigkeit zur Evolution.[3]
Alle bekannten Viroide sind Bewohner höherer Pflanzen und verursachen meist Krankheiten, deren jeweilige wirtschaftliche Bedeutung für den Menschen sehr unterschiedlich ist. Manche davon sind bedeutende Pflanzenpathogene der Landwirtschaft. Die American Phytopathological Society hat (in einer im Jahr 2000 erschienenen Zusammenstellung der wichtigsten Meilensteine des vergangenen Millenniums in der Pflanzenpathologie) Theodor Otto Dieners Entdeckung der Viroide im Jahr 1971 als eine der zehn wichtigsten Erreger-Entdeckungen des Millenniums anerkannt.[4]
Geschichte

Zur Entdeckung des ersten Viroids führten Bestrebungen, den Erreger der Spindelknollensucht der Kartoffelpflanze zu isolieren und zu charakterisieren. Anfang der 1920er Jahre wurde in den US-Bundesstaaten New York und New Jersey diese Erkrankung von Kartoffeln erstmals beobachtet.[5] Die infektiöse Natur der Krankheit wurde 1923 von Eugene S. Schultz und Donald Folsom erkannt, doch blieb die besondere Natur des Erregers zunächst unbekannt und er wurde den Pflanzenviren zugeordnet.[6]
Dem am Pioneering Laboratory for Plant Virology des Agricultural Research Service in Beltsville, Maryland tätigen Pflanzenpathologen Theodor O. Diener gelang 1971 die Isolierung und Charakterisierung des Erregers als eine zum damaligen Kenntnisstand ungewöhnlich kleine, proteinfreie und unabhängig replizierende RNA. Diener schlug den Namen Viroid – also Virus-ähnlich – für diese Erregergruppe vor.[7][8][9]
In den folgenden Jahren klärten Diener und andere Gruppen viele der molekularen Eigenschaften von Viroiden auf. So konnten Stollar und Diener im Jahr 1971 mit immunologischen Versuchen zeigen, dass Viroide nicht doppelsträngige, sondern einzelsträngige RNA sind und dass keine Viroid-spezifischen RNA-DNA Hybride existieren. Sogo et al. untersuchten 1973 Viroid-RNA mit Hilfe der Elektronenmikroskopie und bestätigten die einsträngige Natur der RNA und die ringförmige Sekundärstruktur der RNA.[10]
Heinz L. Sänger et al. konnten 1976 am Institut für Virologie der Justus-Liebig-Universität Gießen die Struktur der Viroide als kovalent geschlossene, einzelsträngige RNA-Ringe mit spezifischen Basenpaarungen innerhalb des RNA-Stranges nachweisen.[11] Henco et al. wiesen helikal gewundene Abschnitte innerhalb des RNA-Ringes nach,[12] mit denen die besondere energetische Stabilität der RNA erklärbar war.[7] Im Jahr 1978 publizierten Hans Joachim Gross et al. die erste Nukleotidsequenz eines Viroids – des PSTVd.[13] Seitdem werden Viroide mit der üblichen drei- oder vier-stelligen Abkürzung benannt, zu der ein „d“ zugefügt wird – also PSTVd für Potato Spindle Tuber Viroid.
Eigenschaften
Viroide bestehen nur aus einer ringförmig geschlossenen, einzelsträngigen Ribonukleinsäure (RNA). Im Gegensatz zu Viren besitzen Viroide keine zusätzlichen Proteine oder Lipide zur Verpackung in Form einer Hülle oder eines Kapsids. Viroide können sich nur innerhalb lebender Zellen vermehren (obligat intrazelluläre Parasiten), weshalb sie auch zusammen mit den Viren, Virusoiden und Prionen die Gruppe der subzellulären Erreger bilden. Für Viroide, zusammen mit Viroid-ähnlichen Satelliten-RNA, hat das International Committee for Taxonomy of Viruses (ICTV) eine eigene Ordnung von subviralen Erregern definiert.[14]
Die RNA der Viroide ist zwischen 241 und 401 Nukleotide lang. Typischerweise wird von dieser genomischen RNA während der Vermehrung in der Zelle keine mRNA transkribiert und damit keine Viroid-eigenen Proteine hergestellt. Die Viroid-RNA besitzt eine eigene katalytische Aktivität unter anderem in Form eines Ribozyms. Der Mechanismus der RNA-Vermehrung und Wechselwirkung mit zellulären Bestandteilen ist ein Modell zum Studium der Funktionalität von RNA in der Zelle. Diese Mechanismen der Viroide werden von vielen als ein molekulares Fossil aus einer frühen Stufe der chemischen Evolution angesehen.[15][16]
Genom und Struktur
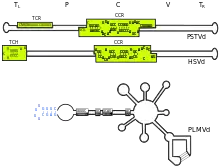
Die RNA der Viroide enthält viele komplementäre Bereiche, wodurch sich doppelsträngige, lineare Strukturen ausbilden, die im Elektronenmikroskop als circa 50 nm lange stäbchenförmige Strukturen beobachtet werden können.
Das Genom des PSTVd wird in fünf Bereiche unterteilt: terminal left (TL), pathogenicity (P), central (C), variable (V) und terminal right (TR). Innerhalb der central-Region liegt die konservierte Sequenz der central conserved region (CCR), in der ein UV-sensitives E-Schleifenmotiv mit ungewöhnlicher Basenpaarung liegt.[2] Innerhalb der central conserved region liegt die stark konservierte RNA-Sequenz GAAAC, die in allen Viroiden vorkommt.

Bei einer Dichtegradientenzentrifugation liegen die Sedimentationskoeffizienten für PSTVd bei 6,7 ± 0,1 S (359 nt Länge), für CEVd bei 6,7 ± 0,1 S (371 nt Länge), für CCCVd-1s bei 5,9 S (247 nt Länge), für CCCVd-1l bei 6,3 ± 0,1 S (302 nt Länge), für CCCVd-2s bei 7,6 ± 0,1 S (494 nt Länge) und für CCCVd-2l bei 8,2 S (604 nt Länge).[17] Unter der Annahme einer ellipsoiden Form der Viroide beträgt das Axialverhältnis (a/b) 20.[17] Das partielle spezifische Volumen v2 der Viroide wurde als 0,53 cm3 / g bestimmt.[17]
Replikation
Im Gegensatz zu Viren codieren Viroide keine Proteine.[18][19] Deshalb sind sie bei ihrer Replikation und ihrem Transport ausschließlich auf Enzyme der Wirtspflanze angewiesen. Dies unterscheidet Viroide grundlegend von Satelliten-Viren, die bei ihrer Replikation auf Helferviren angewiesen sind.
Die Replikation erfolgt per rolling circle replication durch die zelluläre RNA-Polymerase II, die sonst normalerweise DNA als Vorlage verwendet.[20][21] Die Mutationsrate bei der Replikation von Viroiden ist die höchste unter allen Nukleinsäure-Replikons.[22] Durch die Ungenauigkeit der Replikation kommen Viroide innerhalb eines Organismus als Quasispezies vor.[2] Allerdings wirken sich viele Mutationen auf die Infektiosität und Pathogenität aus.[23] Durch die rolling circle replication entsteht ein langer RNA-Strang aus mehreren seriellen Kopien des Genoms (ein Multimer), der vermutlich erst durch die zelluläre RNase (DCL1 und DCL4 hydrolysieren Pospiviroidae, DCL2 und DCL3 bei allen Viroiden)[24] in die einzelnen Genome geschnitten werden (zum Monomer). Die Viroide aus der Gruppe der Avsunviroidae können sich zudem autokatalytisch hydrolysieren.[25] Der Ringschluss der neu erzeugten Viroid-RNA erfolgt vermutlich durch eine zelluläre DNA-Ligase, die sonst normalerweise DNA als Vorlage verwendet.[26] Bei Avsunviroidae erfolgt eine Ligation autokatalytisch.[25]
Das Hepatitis-D-Virus (HDV) besitzt eine Ribozymaktivität ähnlich zu den Viroiden.[27]
Pathogenität
Der genaue Mechanismus, über den die Viroid-RNA bei den Pflanzen pathogen wirkt, ist bisher nicht bekannt. Es sind verschiedene Modelle vorgeschlagen worden (z. B. RNA silencing). Eine Überexpression von einer nichtinfektiösen shRNA mit einer bestimmten Sequenz des PSTVd führt zu ähnlichen Symptomen wie eine Infektion mit PSTVd.[28] Zudem ist eine Teilsequenz des PSTVd komplementär zu bestimmten mRNA von Pflanzen.[29] Während einer Infektion mit Viroiden werden im Zuge der pflanzlichen Abwehr des Viroids durch Dicer-artige und AGO-Proteine der Pflanze kurze RNA-Fragmente gebildet (vd-sRNA). Durch diese kurzen Fragmente wird die Resistenz der Wirtspflanze geschwächt.[30]
Transmission
Viroide werden mechanisch bzw. durch eine Schmierinfektion, insbesondere nach Verletzung, aber auch durch Pollen und Samen übertragen, wobei der Anteil der Übertragungswege unbekannt ist.[2] Bei einer Koinfektion der Pflanze mit PSTVd und dem potato leafroll virus (PLRV, ein Polerovirus) oder dem velvet tobacco mottle virus (VTMoV, ein Sobemovirus) wird die Transmission von PSTVd verstärkt, vermutlich durch eine Verpackung des Viroids im Viruskapsid.[2] Daneben wurde eine Transmission durch Röhrenblattläuse (Aphididae) oder Hummeln vermutet.[31] Die Ausbreitung innerhalb einer Pflanze erfolgt über Plasmodesmen. Die Infektion ist lebenslang (persistent).[32]
Systematik
Auf der Grundlage von Sequenzvergleichen bereits charakterisierter Viroid-RNA (derzeit 29 Arten und eine Vielzahl von Varianten) und ihrer unterschiedlichen katalytischen und strukturellen Eigenschaften werden die Viroide in zwei Virusfamilien und acht Gattungen eingeteilt.[2][17][33] Der prototypische Vertreter der Pospiviroide ist das PSTVd und der für die Avsunviroide ist Avocado sunblotch viroid (ASBVd).[2] Während Pospiviroide sich im Zellkern replizieren, entstehen Avsunviroide im Chloroplasten.[2]
Die offiziellen Namen der Viroid-Taxa haben im Unterschied zu echten Viren in allen Rangstufen „viroid“ statt nur „vir“ als Bestandteil der Namensendung, die Abkürzungen enden auf „Vd“ statt „V“, ggf. gefolgt von einer Nummer (nicht römisch, sondern arabisch). Mit Stand ICTV November 2018 sind folgende Rangstufen im Gebrauch:
- Familie (…viroidae)
- Gattung oder Genus (…viroid)
- Art oder Species (…viroid)
- Gattung oder Genus (…viroid)
- Familie (…viroidae)
Die Taxonomie ist im Detail wie folgt:
- Familie Avsunviroidae[34]
- Gattung Avsunviroid
- ASBVd (Avocado sunblotch viroid)
- Gattung Elaviviroid
- ELVd (Eggplant latent viroid)
- Gattung Pelamoviroid
- CChMVd (Chrysanthemum chlorotic mottle viroid)
- PLMVd (Peach latent mosaic viroid)
- Familie Pospiviroidae[35]
- Gattung Apscaviroid
- ADFVd (Apple dimple fruit viroid)
- ASSVd (Apple scar skin viroid)
- AGVd (Australian grapevine viroid)
- CBLVd (Citrus bent leaf viroid)
- CDVd (Ccitrus dwarfing viroid), früher CVd-III (Citrus viroid III)[36]
- CVd-V (Citrus viroid V)
- CVd-VI (Citrus viroid VI)
- GYSVd 1 (Ggrapevine yellow speckle viroid 1)
- GYSVd 2 (Grapevine yellow speckle viroid 2)
- PBCVd (Pear blister canker viroid)
- Gattung Cocadviroid
- CBCVd (Citrus bark cracking viroid), früher CVd-IV (Citrus viroid IV)
- CCCVd (Coconut cadang-cadang viroid)
- CTiVd (Coconut tinangaja viroid)
- HLVd (Hop latent viroid)
- Gattung Coleviroid
- CbVd 1 (Coleus blumei viroid 1)
- CbVd 2 (Coleus blumei viroid 2)
- CbVd 3 (Coleus blumei viroid 3)
- Gattung Hostuviroid
- DLVd (Dahlia latent viroid)
- HSVd (Hop stunt viroid)
- Gattung Pospiviroid
- CSVd (Chrysanthemum stunt viroid)
- CEVd (Citrus exocortis viroid, de. Citrus-Exocortis-Viroid)
- CLVd (Columnea latent viroid)
- IrVd (Iresine viroid 1)
- PCFVd (Pepper chat fruit viroid)
- PSTVd (Potato spindle tuber viroid, de. Potato-Spindle-Tuber-Viroid)
- TASVd (Tomato apical stunt viroid)
- TCDVd (Tomato chlorotic dwarf viroid)
- TPMVd (Tomato planta macho viroid), synonym mit früher unterschiedenem MPVd (Mexican papita viroid)
Biologische Bedeutung
Viroide treten nur als Krankheitserreger von Gefäßpflanzen auf (Pflanzenpathogene). Über 30 Krankheiten von Gefäßpflanzen werden durch Viroide verursacht. Die Infektionen betreffen viele verschiedene Kulturpflanzen, wobei die resultierende Erkrankung je nach Umweltbedingung und Wirt-Erreger-Verhältnis entweder nicht oder nur milde ausbrechen oder aber zu schweren Schädigungen und Absterben der Pflanzen führen kann. Die wirtschaftlichen Schäden durch Viroide betreffen vorwiegend Kartoffelpflanzen, Tomaten, Zitrusfrüchte, Weintrauben, Hopfen und Zierpflanzen. In Tieren wurden Viroide bisher nicht entdeckt. Ein typisches Beispiel ist das Kartoffelspindelknollen-Viroid Potato Spindle Tuber Viroid (Abk. PSTVd), welches Kartoffeln, Tomaten und viele andere Pflanzenarten befällt und großen wirtschaftlichen Schaden anrichtet.[37][38]
Diagnostik und Therapie
Die Identifikation von einzelnen Viroiden erfolgt über einen Northern Blot mit einer Hybridisierungssonde und zunehmend auch per RT-PCR und qRT-PCR.[38] Die Therapie besteht aus Exklusion oder Eradikation der infizierten Pflanzen.[38]
Umweltstabilität
Die Tenazität der Viroide ist stammabhängig. PSTVd wird durch wiederholtes Einfrieren und Auftauen inaktiviert.[17] Viroide sind generell empfindlich gegenüber Bleichmitteln, Chaotropen in höheren Konzentrationen und Denaturierung durch Erhitzen, wobei die Struktur der Viroide durch zweiwertige Magnesiumionen stabilisiert wird und die Denaturierungstemperatur konzentrationsabhängig um bis zu 30 °C steigt.[17]
Literatur
- David M. Knipe, Peter M. Howley (eds.-in-chief): Fields’ Virology. 5. Auflage, Philadelphia 2007, ISBN 0-7817-6060-7.
- B. Ding, A. Itaya: Viroid: a useful model for studying the basic principles of infection and RNA biology. Mol Plant Microbe Interact. (2007) 20(1): S. 7–20 (Review), PMID 17249418.
- E. M. Tsagris, A. E. Martínez de Alba, M. Gozmanova, K. Kalantidis: Viroids. Cell Microbiol. (2008) 10(11): S. 2168–2179 (Review), PMID 18764915.
- F. Di Serio, R. Flores, J. T. Verhoeven, S. F. Li, V. Pallás, J. W. Randles, T. Sano, G. Vidalakis, R. A. Owens: Current status of viroid taxonomy. In: Archives of virology. Band 159, Nummer 12, Dezember 2014, S. 3467–3478, doi:10.1007/s00705-014-2200-6, PMID 25216773.
Weblinks
- Systematik der Viroide in der Datenbank des NCBI
Einzelnachweise
- Die Prionen, auch subzelluläre Krankheitserreger, sind noch kleiner, aber besitzen kein eigenes Erbgut.
- R. Flores, R. A. Owens: Viroids. In: Brian W. J. Mahy und Marc H. van Regenmortel (eds.): Encyclopedia of Virology, 3. Auflage, San Diego 2008, Band 5, S. 332–342, ISBN 978-0-12-373935-3.
- Karin Mölling: Supermacht des Lebens. Reisen in die erstaunliche Welt der Viren. 1. Auflage, Beck, München 2015, ISBN 978-3-406-66969-9.
- From Y1K to 2K: Millennial Milestones in Plant Pathology, American Phytopathological Society Publications, APSnet Features, (abgefasst by Thor Kommedahl, University of Minnesota), 2000, 7pp. Online. DOI:10.1094/APSFeature-2000-0100.
- R. A. Owens, J. Th. J. Verhoeven: Potato Spindle Tuber. In: Plant Health Instructor. 2009, doi:10.1094/PHI-I-2009-0804-01.
- E. S. Schultz, D. Folsom: A "spindling-tuber disease" of irish potatoes. Science (1923) 2;57(1466): S. 149, PMID 17831586.
- T. O. Diener: Potato spindle tuber "virus". IV. A replicating, low molecular weight RNA. In: Virology. Band 45, Nummer 2, August 1971, S. 411–428, PMID 5095900.
- B. D. Stollar, T. O. Diener: Potato spindle tuber viroid. V. Failure of immunological tests to disclose double-stranded RNA or RNA-DNA hybrids. In: Virology. Band 46, Nummer 1, Oktober 1971, S. 168–170, PMID 5166353.
- T. O. Diener: Potato spindle tuber viroid. 8. Correlation of infectivity with a UV-absorbing component and thermal denaturation properties of the RNA. In: Virology. Band 50, Nummer 2, November 1972, S. 606–609, PMID 4636118.
- J. M. Sogo, T. Koller, T. O. Diener: Potato spindle tuber viroid. X. Visualization and size determination by electron microscopy. In: Virology. Band 55, Nummer 1, September 1973, S. 70–80, PMID 4728831.
- H. L. Sänger, G. Klotz, D. Riesner, H. J. Gross, A. K. Kleinschmidt: Viroids are single-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures. In: Proceedings of the National Academy of Sciences. Band 73, Nummer 11, November 1976, S. 3852–3856, PMID 1069269, PMC 431239 (freier Volltext).
- K. Henco, D. Riesner, H. L. Sänger: Conformation of viroids. Nucleic Acids Res. (1977) 4(1): S. 177–194, PMID 866174, PMC 342418 (freier Volltext).
- H. J. Gross, H. Domdey, C. Lossow, P. Jank, M. Raba, H. Alberty, H. L. Sänger: Nucleotide sequence and secondary structure of potato spindle tuber viroid. In: Nature. Band 273, Nummer 5659, Mai 1978, S. 203–208, PMID 643081.
- A. M. Q. King, M. J. Adams, E. B. Carstens, E. J. Lefkovitz, et al.: Virus Taxonomy. Elsevier Academic Press, 2012. S. 1221–1259, TN: 949565
- T. O. Diener: Viroids: "living fossils" of primordial RNAs? In: Biology direct. Band 11, Nummer 1, März 2016, S. 15, doi:10.1186/s13062-016-0116-7, PMID 27016066, PMC 4807594 (freier Volltext).
- B. Ding, A. Itaya: Viroid: a useful model for studying the basic principles of infection and RNA biology. Mol Plant Microbe Interact. (2007) 20(1): S. 7–20 (Review), PMID 17249418 (Volltext).
- A. Hadidi, R. Flores, J. W. Randles, J. S. Semancik: Viroids. Csiro Publishing, 2003, ISBN 978-0-643-06789-9, S. 18, 38.
- E. M. Tsagris, A. E. Martínez de Alba, M. Gozmanova, K. Kalantidis: Viroids. In: Cellular microbiology. Band 10, Nummer 11, November 2008, S. 2168–2179, doi:10.1111/j.1462-5822.2008.01231.x, PMID 18764915.
- Ricardo Flores, Francesco DiSerio, Carmen Hernández: Viroids: The Noncoding Genomes. In: Seminars in Virology. 8, Nr. 1, Februar 1997, S. 65–73. doi:10.1006/smvy.1997.0107SA.
- R. Flores, P. Serra, S. Minoia, F. Di Serio, B. Navarro: Viroids: from genotype to phenotype just relying on RNA sequence and structural motifs. In: Frontiers in microbiology. Band 3, 2012, S. 217, doi:10.3389/fmicb.2012.00217, PMID 22719735, PMC 3376415 (freier Volltext).
- J. A. Daròs, S. F. Elena, R. Flores: Viroids: an Ariadne's thread into the RNA labyrinth. In: EMBO reports. Band 7, Nummer 6, Juni 2006, S. 593–598, doi:10.1038/sj.embor.7400706, PMID 16741503, PMC 1479586 (freier Volltext).
- B. Ding: Viroids: self-replicating, mobile, and fast-evolving noncoding regulatory RNAs. In: Wiley interdisciplinary reviews. RNA. Band 1, Nummer 3, 2010 Nov-Dec, S. 362–375, doi:10.1002/wrna.22, PMID 21956936.
- R. W. Hammond: Analysis of the virulence modulating region of potato spindle tuber viroid (PSTVd) by site-directed mutagenesis. In: Virology. Band 187, Nummer 2, April 1992, S. 654–662, PMID 1546460.
- M. V. Nayudu: Plant Viruses. Tata McGraw-Hill Education, 2008, ISBN 978-0-070-65660-4, S. 454.
- Nicholas H. Acheson. Fundamentals of Molecular Virology. 2. Auflage. John Wiley & Sons, 2011, ISBN 978-0-470-90059-8, S. 379–383.
- R. Flores, S. Minoia, A. Carbonell, A. Gisel, S. Delgado, A. López-Carrasco, B. Navarro, F. Di Serio: Viroids, the simplest RNA replicons: How they manipulate their hosts for being propagated and how their hosts react for containing the infection. In: Virus research. Band 209, November 2015, S. 136–145, doi:10.1016/j.virusres.2015.02.027, PMID 25738582.
- C. Alves, C. Branco, C. Cunha: Hepatitis delta virus: a peculiar virus. In: Advances in virology. Band 2013, 2013, S. 560105, doi:10.1155/2013/560105, PMID 24198831, PMC 3807834 (freier Volltext).
- M. B. Wang, X. Y. Bian, L. M. Wu, L. X. Liu, N. A. Smith, D. Isenegger, R. M. Wu, C. Masuta, V. B. Vance, J. M. Watson, A. Rezaian, E. S. Dennis, P. M. Waterhouse: On the role of RNA silencing in the pathogenicity and evolution of viroids and viral satellites. In: Proceedings of the National Academy of Sciences. Band 101, Nummer 9, März 2004, S. 3275–3280, doi:10.1073/pnas.0400104101, PMID 14978267, PMC 365780 (freier Volltext).
- V. Pallas, G. Martinez, G. Gomez: The interaction between plant viroid-induced symptoms and RNA silencing. In: Methods in molecular biology. Band 894, 2012, S. 323–343, doi:10.1007/978-1-61779-882-5_22, PMID 22678590.
- W. A. Miller, R. Shen, W. Staplin, P. Kanodia: Noncoding RNAs of Plant Viruses and Viroids: Sponges of Host Translation and RNA Interference Machinery. In: Molecular plant-microbe interactions : MPMI. Band 29, Nummer 3, März 2016, S. 156–164, doi:10.1094/MPMI-10-15-0226-FI, PMID 26900786, PMC 5410770 (freier Volltext).
- J. A. Bokx, P. G. M. Piron: Transmission of potato spindle tuber viroid by aphids. In: Netherlands Journal of Plant Pathology. 87, 1981, S. 31, doi:10.1007/bf01976653.
- P.D. Sharma: Microbiology & Plant Pathology. Rastogi Publications, 2010, ISBN 978-8-171-33740-8, S. 202.
- SIB: Circular Single Strand RNA Viruses: Viroids, auf: ViralZone
- SIB: Avsunviroidae, auf: ViralZone
- SIB: Pospiviroidae, auf: ViralZone
- Taxonomic Proposal to the ICTV Executive Committee To rename an existing Virus Name
- Jeffrey C Pommerville: Fundamentals of Microbiology. Jones and Bartlett Learning, Burlington, MA 2014, ISBN 978-1-284-03968-9, S. 482.
- R. W. Hammond, R. A. Owens: Viroids: New and Continuing Risks for Horticultural and Agricultural Crops.. In: APSnet Feature Articles. 2006. doi:10.1094/APSnetFeature-2006-1106.