Valsartan-Skandal
Der Valsartan-Skandal (auch Sartan-Skandal) umfasst Vorkommnisse um das Auftreten von wahrscheinlich krebserregenden Verunreinigungen in Blutdrucksenkern aus der Wirkstoffgruppe der Sartane.
Erstmals wurde im Juli 2018 eine Verunreinigung des Wirkstoffs Valsartan eines chinesischen Herstellers bekannt, Fälle von Valsartan weiterer Hersteller und von anderen Sartanen folgten.
Aufdeckung und erste Arzneimittelrückrufe
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informierte am 4. Juli 2018 über einen EU-weiten chargenbezogenen Rückruf valsartanhaltiger Arzneimittel, deren Wirkstoff von dem chinesischen Hersteller Zhejiang Huahai Pharmaceutical (ZHP) produziert worden war. Auslöser für die Rückrufe sei eine produktionsbedingte Verunreinigung des Wirkstoffs mit N-Nitrosodimethylamin (NDMA); dieser Stoff sei von der Internationalen Agentur für Krebsforschung (IARC) und der EU als wahrscheinlich krebserregend beim Menschen eingestuft. Patientinnen und Patienten, die valsartanhaltige Arzneimittel einnehmen, sollten aber die Arzneimittel nicht ohne Rücksprache mit ihrer Ärztin oder ihrem Arzt absetzen, da das gesundheitliche Risiko eines Absetzens um ein Vielfaches höher liege als das mögliche Risiko durch eine Verunreinigung. Ein akutes Patientenrisiko bestehe nicht.[1][2] Das BfArM erläuterte von einer Landesüberwachungsbehörde informiert worden zu sein. Die Meldung basiere auf den Untersuchungsergebnissen des Wirkstoffherstellers, welche im Rahmen der Produktion für einen Fertigarzneimittelhersteller aus Spanien durchgeführt wurden. Das BfArM gab weder den Namen der mitteilenden Landesüberwachungsbehörde an, noch den Zeitpunkt seiner Information.[3] Nach Angabe des ehemaligen Leiters der Toxikologie der Berliner Charité, Ralf Stahlmann, wurde die Kontamination nicht bei vorgeschriebenen Kontrollen entdeckt, sondern erst nach einem anonymen Hinweis.[4]

Am 5. Juli 2018 veröffentlichte die Europäische Arzneimittel-Agentur (EMA), nach der Entdeckung einer Verunreinigung mit NDMA überprüfe sie auf Anforderung durch die Europäische Kommission gemäß Artikel 31 der Richtlinie 2001/83/EG solche Medikamente, die als Wirkstoff Valsartan vom Hersteller Zhejiang Huahai enthielten. In der EU seien durch nationale Behörden vorsorglich bereits einige Medikamente mit dem Wirkstoff zurückgerufen worden.[5][6] Die EMA gab in beiden Veröffentlichungen an, die Verunreinigung mit NDMA sei „unerwartet“ („unexpected“) gewesen. Dagegen vertreten andere den Standpunkt, dass sowohl dem Wirkstoffhersteller als auch den Prüfern der europäischen Behörde für Arzneimittelqualität (EDQM), das Risiko der NDMA-Bildung bereits 2012 hätte auffallen müssen. In dem Jahr hatte das EDQM die Eignung des vom Hersteller angewendeten Prüfverfahrens für Valsartan genehmigt. Zu diesem Zweck habe das Unternehmen Zhejiang Huahai damals dem EDQM pflichtgemäß eine Änderung des Synthesewegs eingereicht, bei dem offenkundig die Gefahr der NDMA-Bildung gegeben sei. Die Verunreinigung mit NDMA sei also aufgrund der bekannten Reaktivitäten der verwendeten Reagenzien „vorhersehbar“ gewesen.[7][8]
Dass auch die Experten des EDQM trotz der ihnen vorgelegten Unterlagen keinen Verdacht geschöpft hätten, deute auf Lücken im Prüfverfahren hin. Nach Ansicht des Vorsitzenden der Arzneimittelkommission der deutschen Ärzteschaft seien die Vorgänge „besorgniserregend und zeigen, dass existierende Maßnahmen zur Qualitätskontrolle und Überwachung der Arzneimittelsicherheit mitunter nicht funktionieren. [...] Insbesondere die für die Arzneimittelüberwachung zuständigen Landesbehörden agieren zu langsam, sind offensichtlich häufig mit diesen Problemen überfordert und verfügen meist auch nicht über ausreichend kompetentes Personal, um diese verantwortungsvolle Aufgabe adäquat wahrzunehmen.“[9]
Toxikologischer Hintergrund
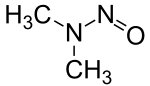
NDMA (N-Nitrosodimethylamin) gilt als ein besonders gefährlicher Vertreter der Nitrosamine. Das BfArM stellte das Spektrum möglicher Schäden durch NDMA zunächst unvollständig dar, indem es nur darauf hinwies, dass NDMA von der IARC und der EU als „wahrscheinlich krebserregend beim Menschen“ eingestuft ist. Tatsächlich jedoch gelten NDMA selbst und vor allem seine stark methylierenden Abbauprodukte auch als erbgutschädigend (genotoxisch). Zudem sind keine Tierarten bekannt, bei denen NDMA Krebs nicht auslöst, und es können dort bereits kleinste Mengen von NDMA krebsauslösend wirken, was die Festlegung einer sicheren toxikologischen Wirkungsschwelle erschwert. Bei Tierversuchen mit Ratten, bei dem über einen Zeitraum von 120 Wochen die Nahrung mit 2000 µg NDMA pro kg Nahrung versetzt war, entwickelte eines von 37 Versuchstieren einen Lebertumor, bei 50000 µg pro kg Nahrung erkrankten 10 von 12 Tieren.[10] Aufgrund der unbekannten Wirkungsschwelle gibt es keinen ADI-Grenzwert (Acceptable Daily Intake) für eine täglich erlaubte NDMA-Menge. Behördliche Angaben wie „nur leicht erhöhte Konzentration“ seien daher nicht sachgerecht. Wie für andere genotoxische Kanzerogene müsse gefordert werden, die Exposition so weit wie möglich zu minimieren und das ALARA-Prinzip (»As Low as Reasonably Achievable«) anzuwenden.[7][11]
Zwar obliegt in der Bundesrepublik Deutschland die Überwachung des Arzneimittelverkehrs und die Überwachung der Guten Herstellungspraxis (GMP) den Bundesländern. Aber außer einer Aufsichtsbehörde in Bayern hat bis heute keine Landes- oder Bundesbehörde eigene Messwerte zur Verunreinigung von Valsartan mit NDMA veröffentlicht. Stattdessen beziehen sich sowohl das BfArM als auch die übrigen Landesbehörden auf Messungen, welche das Zentrallaboratorium Deutscher Apotheker (ZL), also ein privatrechtlicher Verein, in eigener Initiative erst Ende Juli 2018 durchgeführt hat.
Chemischer Hintergrund
Für das Entstehen von krebserregenden Nitrosaminverbindungen wie dem N-Nitrosodimethylamin (NDMA) werden Syntheseschritte zum Aufbau des im Molekül bestimmter Sartane vorkommenden Tetrazolringes als ursächlich angesehen.
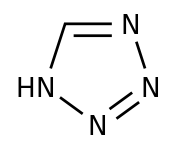 Tetrazol
Tetrazol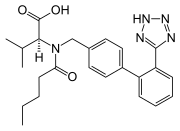 Valsartan
Valsartan Irbesartan
Irbesartan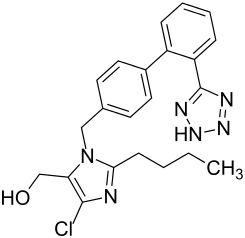 Losartan
Losartan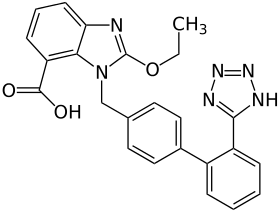 Candesartan
Candesartan
So ist beschrieben, dass Zhejiang Huahai Pharmaceutical (ZHP) 2014 ein Patent für eine verbesserte Synthese von Valsartan veröffentlichte. Während in der früheren Synthesevariante der Tetrazolring ausgehend von einer cyanosubstituierten, aromatischen Zwischenstufe durch 1,3-dipolare Cycloaddition unter Verwendung von Tributylzinnazid aufgebaut wurde, erfolgt in der neuen Synthese die Cyclisierungsreaktion mittels Natriumazid, unter Katalyse mit Zinkchlorid und in Gegenwart von Natriumnitrit in saurem Milieu. Bei diesem Syntheseschritt fungiert Dimethylformamid (DMF) als Lösungsmittel. Unter ungünstigen Reaktionsbedingungen während des Syntheseprozesses kann sich in DMF das Abbauprodukt Dimethylamin (DMA) bilden und bei dem Zusammentreffen von DMA mit Nitrit-Ionen NDMA entstehen.[12][13] Diese Verunreinigung kann mit dem Prüfverfahren im aktuell gültigen Arzneibuch nicht festgestellt werden, da die Monographie auf Basis anderer Syntheseverfahren auf das Vorhandensein von anderen Verunreinigungen ausgerichtet ist und nicht auf die Bestimmung von NDMA.
Vorteilhaft an dem von ZHP geänderten Syntheseweg von Valsartan soll sein, dass der Umgang mit dem hochtoxischen und explosiven Tributylzinnazid entfällt zugunsten von leichter zu handhabenden Reagenzien. Auch Aspekte der Aufreinigung des Wirkstoffs und der Syntheseausbeute können eine Rolle spielen.[13]
Neben NDMA ist auch die Bildung einer Reihe an weiteren flüchtigen und nicht flüchtigen Nitrosaminen in Sartan-Synthesen denkbar. Je nachdem, welches Amin mit welchem Nitrosylierungsreagenz unter welchen Bedingungen zusammenkommt, könnten unterschiedliche Nitrosamine entstehen. Eine wichtige Rolle spielt dabei auch das verwendete Lösungsmittel. Das ZL schätzt jedoch die Wahrscheinlichkeit, dass mit NDMA und N-Nitrosodiethylamin (NDEA) die wesentlichen Nitrosamine erfasst wurden, basierend auf der jetzigen Datenlage als hoch ein.[13]
Bei von anderen Wirkstoffherstellern verwendeten Lösungsmitteln wie Toluol beziehungsweise o-Xylol anstelle von DMF ist eine Reaktion mit Natriumnitrit zu NDMA ausgeschlossen.[14]
Weitere Sartan-Fälle
- Valsartan
Zusätzlich zum chinesischen Hersteller Zhejiang Huahai wurden Verunreinigungen durch das krebsgefährdende NDMA in Valsartan-Chargen weiterer Hersteller nachgewiesen: Die US-amerikanische Arzneimittelbehörde FDA teilte am 9. August 2018 mit, dass Valsartan auch aus der Herstellung durch den indischen Wirkstoffproduzenten Hetero Labs Limited mit NDMA verunreinigt sei und daher Medikamente mit Valsartan aus dieser Quelle aus dem US-amerikanischen Markt zurückgerufen würden. Nach Angaben des BfArM waren Arzneimittel des deutschen Markts nicht betroffen.[15] Am 10. August 2018 wurde auf europäischer Ebene darüber informiert, dass auch beim chinesischen Hersteller Zhejiang Tianyu leicht erhöhte NDMA-Werte gemessen wurden. Die Regierung von Oberbayern habe daher am 14. August 2018 den Rückruf der einzigen in Deutschland betroffenen Charge angeordnet.[2]
- Irbesartan
Zahlreiche Rückrufe von Präparaten mit dem Tetrazol-Sartan Irbesartan wurden über die Arzneimittelkommission der Deutschen Apotheker (AMK) gemeldet. Erstmals im Juli 2018 wurde ein Irbesartan-Präparat vorsorglich vom Markt genommen. Analytisch konnten keine Verunreinigungen festgestellt werden. Im Oktober 2018 entzog das EDQM dem indischen Wirkstoffhersteller Aurobindo Pharma die Konformitätsbescheinigung (CEP) für Irbesartan, nachdem geringe Mengen an NDEA festgestellt worden waren.[16] Im Januar 2019 verlor Zhejiang Huahai Pharmaceutical sein CEP.[17]
- Losartan
Auch der Wirkstoff Losartan war vom Auftreten von Nitrosaminverunreinigungen betroffen: Im September 2018 wurden in Losartan des indischen Herstellers Hetero Labs Spuren des potenziell krebserregenden Stoffs N-Nitrosodiethylamin (NDEA) gefunden. Ende Dezember 2018 kam es zu Rückrufen zweier verunreinigter Arzneimittelchargen in Deutschland.[18] Im Januar 2019 wurde Zhejiang Huahai Pharmaceutical vom EDQM die Konformitätsbescheinigung (CEP) für Losartan entzogen.[17] Im Februar 2019 gab es Rückrufe aufgrund der erstmals gefundenen Nitrosaminverbindung N-Nitroso-N-methyl-4-aminobuttersäure (NMBA).[19]
- Candesartan
Knapp ein Jahr nach der ersten Entdeckung von Nitrosaminen in Sartanen wurde im Juni 2019 erstmals auch für Candesartan, dem vierten Sartan mit Tetrazol-Ring, das Auftreten des Nitrosamins N-Nitrosodiethylamin (NDEA) in sehr geringen Mengen beschrieben.[20]
Konsequenzen
Die über vermutlich sechs Jahre hinweg erfolgte Verunreinigung eines Medikaments mit einer als krebsgefährdend beim Menschen angesehenen Chemikalie betrifft eine sehr große Zahl von Menschen: Allein in Deutschland sind 2017 nach Auskunft des dortigen Bundesministeriums für Gesundheit etwa neun Millionen Packungen valsartanhaltiger Arzneimittel verordnet worden. Da rund 40 Prozent der Chargen kontaminiert sind, könnten etwa 900.000 Patientinnen und Patienten betroffen sein.[21]
Risiko-Abschätzung
NDMA gehört zur Gruppe der Nitrosamine. Normalerweise nimmt ein Westeuropäer pro Tag im Schnitt 0,3 µg Nitrosamine mit der Nahrung zu sich. Beim Rauchen von 20 Zigaretten am Tag kann sich die aufgenommene Menge auf 17 bis 85 µg erhöhen.[11] Messungen durch Behörden und Organisationen wie etwa das Zentrallaboratorium Deutscher Apotheker haben aber in den zurückgerufenen Medikamenten zwischen 3,7 und 22 µg NDMA pro Tablette nachgewiesen.[9] In einer einzigen Valsartan-Tablette könnte also die 75-fache Menge an NDMA enthalten sein, als normalerweise Nitrosamine insgesamt pro Tag aus der Nahrung aufgenommen werden. Der höchstzulässige Wert für NDMA in Trinkwasser beträgt 0,1 µg/l, bei Bier wird der technische Richtwert von 0,5 µg Nitrosamine pro kg regelhaft unterschritten. In einem kg nach heutigem Verfahren produziertem Räucherschinken befinden sich etwa 2,5 µg Nitrosamine, also gerade einmal ein Zehntel dessen, was in manchen Tabletten gefunden wurde.
Die EMA führte wiederholt aus, es bestehe durch die Verunreinigung von Valsartan-Medikamenten „kein akutes Gesundheitsrisiko“. Dieselbe Behörde veröffentlicht allerdings, dass es pro 5.000 Patienten, die die betroffenen Arzneimittel täglich mit der höchsten Valsartandosis (320 mg) über einen Zeitraum von sieben Jahren eingenommen haben, schätzungsweise einen zusätzlichen Krebsfall geben könne.[9][22] Ähnlich schätzte die FDA unter der Annahme, dass Patienten über vier Jahre hinweg NDMA-verunreinigtes Valsartan ebenfalls in der höchsten Dosierung (320 mg) eingenommen haben, dass bei 8.000 solcher Patienten ein zusätzlicher Krebsfall auftreten könne.[3][21]
Die geschätzten zusätzliche Fälle an Krebserkrankung durch NDMA in Valsartan-Medikamenten müssen vor dem Hintergrund gesehen werden, dass etwa einer von drei Europäern im Lauf seines Lebens einmal an Krebs erkrankt.[22]
Forderungen aufgrund der Valsartan-Affäre
Als Konsequenz aus dem Valsartan-Vorgang leiten Fachleute aus Toxikologie und Arzneimittelqualität folgende Forderungen ab:[11][4]
- strengere Überwachung der Wirkstoffhersteller insbesondere bei Änderung von Herstellungsverfahren
- vorausschauende Screeninganalytik seitens des Fertigarzneimittelherstellers, um nicht mitgeteilte Änderungen im Herstellungsverfahren zu erkennen
- mehr materielle, personelle und fachliche Ressourcen und bessere gegenseitige Abstimmung der zuständigen Behörden
- Beenden der Abhängigkeit der Industriestaaten von Pharmaprodukten aus Billiglohnländern
- mehr Transparenz auf dem Arzneimittelmarkt
Analog zur langfristigen Einwirkung krebsgefährdender Stoffe etwa in der Arbeitswelt stellen sich laut der Wochenzeitung »Die Zeit« zudem Fragen wie: Muss man die Gesundheit der betroffenen Patientinnen und Patienten überwachen? Wen trifft juristisch die Schuld an etwaigen Schäden?[7]
Nach der Entdeckung weiterer, der bislang nicht beschriebenen Verunreinigungen Valeramid (VLA) und Dimethylvaleramid (VLA-DIM) – bei welchen es sich jedoch nicht um als krebserregend geltende Nitrosamine handelt – forderten Wissenschaftler erneut, Arzneimittelherstellungsprozesse generell einer breiter angelegten Überprüfung zu unterziehen, da es unwahrscheinlich sei, dass nur Sartane betroffen seien.[23]
Maßnahmen gemäß CHMP-Gutachten
Die Europäische Kommission leitete am 5. Juli 2018 für Valsartan ein Risikobewertungsverfahren ein, das im September 2018 auf Arzneimittel erweitert wurde, die Candesartan, Irbesartan, Losartan oder Olmesartan enthielten. Sartane ohne Tetrazolring wie Azilsartan, Eprosartan und Telmisartan wurden in die Überprüfung nicht einbezogen. Durchgeführt wurde die Bewertung vom Ausschuss für Humanarzneimittel (CHMP) der europäischen Arzneimittelagentur (EMA), der im Februar 2019 seine Stellungnahme veröffentlichte.[24] Demzufolge waren für die Mehrheit von sartanhaltigen Arzneimitteln die Verunreinigungen NDMA und NDEA entweder nicht nachweisbar oder nur in sehr geringen Mengen vorhanden. Nach neuen Berechnungen schätzt die EMA die Erhöhung des Risikos, irgendwann im Leben an Krebs zu erkranken, gegenüber dem Grundrisiko als sehr gering ein. Nach dem Willen des CHMP sollen pharmazeutische Unternehmer zukünftig alle notwendigen Maßnahmen ergreifen und sicherstellen, dass solche Verunreinigungen nicht auftreten. Langfristig sollen keine Nitrosaminverunreinigungen mehr messbar sein, d. h. die Mengen müssen unterhalb der Nachweisgrenze von 0,03 ppm liegen. Eine Übergangszeit von zwei Jahren soll den Firmen ermöglichen, die erforderlichen Änderungen in ihren Herstellungsverfahren vorzunehmen und Testverfahren einzuführen, die empfindlich und spezifisch genug sind, kleinste Mengen dieser Verunreinigungen in den produzierten Wirkstoffen zu erfassen. Bis dahin schlägt der CHMP die vorübergehende Anwendung von Grenzwerten vor, die auf einer zulässigen maximalen Tagesdosis von 96,0 ng NDMA bzw. 26,5 ng NDEA beruhen und aus Tierstudien abgeleitet wurden.
Mit Bescheid der EU-Kommission im April 2019[25] wurde das CHPM-Gutachten für alle EU-Mitgliedstaaten rechtsverbindlich; im März 2020 ordnete in Deutschland die Behörde das Ruhen für Arzneimittelzulassungen an, für die die vorgesehenen risikominimierenden Maßnahmen noch nicht oder nicht vollständig umgesetzt worden waren.[26]
Die Arzneibuchmonografien der betroffenen Sartane wurden mit der 10. Ausgabe des europäischen Arzneibuchs (Ph. Eur. 10) vom 1. Juli 2019 aktualisiert und Grenzwerte für die Nitrosamine NDMA und NDEA aufgenommen.[27]
Das Auftreten von nitrosaminhaltigen Verunreinigungen in Arzneimitteln auch unter Einschluss weiterer Substanzen wie N-Nitrosoethylisopropylamin (EIPNA), N-Nitrosodiisopropylamin (DIPNA) und N-Nitroso-N-methyl-4-aminobuttersäure (NMBA) war Gegenstand weiterer Untersuchungen der EMA und nationaler Arzneimittelbehörden. Im August 2019 ergänzte die EMA ihr Papier vom Februar um übergangsweise Grenzwerte für DIPNA, EIPNA und NMBA.[27] Wie für NDMA und NDEA wurden zulässige Tagesdosen von maximal 96,0 ng (für NMBA) bzw. 26,5 ng (DIPNA, EIPN) zugrunde gelegt.[28]
Auch die US-amerikanische Behörde US-FDA gibt Grenzwerte für Nitrosamine in Sartanen vor.[27]
Weitere Wirkstoffklassen
Sensibilisiert durch die Sartan-Vorfälle haben die Behörden ihre Untersuchungen auf weitere Arzneistoffe ausgeweitet.
Im April 2019 berichtete die Europäische Arzneimittelbehörde EMA über Funde geringer Mengen an NDMA in einigen Chargen des Antidiabetikums Pioglitazon eines indischen Herstellers.[29] Im September 2019 informierten sowohl die Food and Drug Administration (US-FDA) als auch die EMA über das Auftreten von NDMA in einigen Arzneimittelchargen, die den Magenschutzwirkstoff Ranitidin enthalten.[30] Die EMA will bewerten, ob eine potenzielle Gefährdung besteht für Patienten, die längere Zeit verunreinigte Ranitidin-Präparate eingenommen haben und leitete ein Risikobewertungsverfahren ein,[31] in den USA rief die US-FDA im April 2020 deswegen alle verschreibungspflichtigen und verschreibungsfreien Ranitidin-Arzneimittel vom Markt zurück.[32] Im Dezember 2019 wurden in Asien einige mit NDMA verunreinigte Metformin-Arzneimittel entdeckt. Metformin wird zur Behandlung des Typ-2-Diabetes eingesetzt.[33]
Leitlinien zur Vermeidung von Nitrosaminverunreinigungen
Der Ausschuss für Humanarzneimittel (CHMP) der EMA wird Leitlinien zur Vermeidung von Nitrosaminverunreinigungen in Humanarzneimitteln, die chemisch synthetisierte Wirkstoffe enthalten, erarbeiten.[34][35]
Weblinks
- Nitrosaminverunreinigungen in Arzneimitteln, auf der Website der europäischen Arzneimittelagentur (englisch)
Einzelnachweise
- Bundesinstitut für Arzneimittel und Medizinprodukte: Valsartan: chargenbezogener Rückruf valsartanhaltiger Arzneimittel, deren Wirkstoff von dem chinesischen Hersteller Zhejiang Huahai Pharmaceutical produziert wurde, Pressemitteilung Nummer 5/18 vom 4. Juli 2018, Abruf am 29. August 2018.
- Rapid Alert des BfArM zu Valsartan, Stand 24. August 2018, Abruf am 29. August 2018.
- BfArM: Hintergründe zum Rapid Alert zu Valsartan, ohne Datumsangabe, Abruf am 29. August 2018.
- Julia Borsch: ZL weist NDMA in Valsartan-Stichproben nach. In: ptaheute.de, 25. Juli 2018, Abruf am 31. August 2018.
- EMA reviewing medicines containing valsartan from Zhejiang Huahai following detection of an impurity. Some valsartan medicines being recalled across the EU, online 5. Juli 2018, Abruf am 29. August 2018, pdf (199 kB) ema.europa.eu
- Update on review of valsartan medicines following detection of impurity in active substance – Assessing potential impact on patients is priority, online 17. Juli 2018, Abruf am 29. August 2018.
- Jakob Simmank: Valsartan: Blutdrucktabletten unter schwerwiegendem Krebsverdacht, in: Die ZEIT, online 27. Juli 2018, Abruf am 29. August 2018.
- D. Uhl: Das Kontrollversagen in der Valsartan-Affäre, Deutsche Apotheker Zeitung, 2. August 2018.
- Dustin Grunert: Arzneimittelsicherheit: Der Fall Valsartan zeigt die Achillesferse der Branche auf, Ärzteblatt, online 20. August 2018, Abruf am 29. August 2018, pdf aerzteblatt.de.
- Volume 17 (1978) Some N-Nitroso Compounds, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans.
- Mona Abdel-Tawab u. a.: Valsartan: ZL findet NDMA in Tabletten, Pharmazeutische Zeitung, Ausgabe 30/2018, Abruf am 29. August 2018.
- H. Buschmann, U. Holzgrabe: NDMA in Valsartan – Eine Spurensuche, Deutsche Apotheker Zeitung 2018, Nr. 29 vom 19. Juli 2018, S. 22 ff.
- Sartan-Produktion – Risikofaktor Ringsynthese, Interview mit Professor Dr. Mona Tawab (ZL), Pharmazeutische Zeitung, 9. November 2018.
- D. Cicek-Görkem, N. Tröbitscher, P. Hollstein: Valsartan: Seit Jahren verunreinigt, Apotheke adhoc, 10. Juli 2018.
- NDMA in Valsartan: Weiterer Wirkstoffproduzent betroffen, Pharmazeutische Zeitung, online 10. August 2018, Abruf am 29. August 2018.
- NDEA: Zweiter Irbesartan-Rückruf, erstes Irbesartan-CEP zurückgezogen, Deutsche Apotheker Zeitung, 11. Oktober 2018.
- NDEA-Fund: Irbesartan und Losartan verlieren CEP-Zertifikate, Deutsche Apotheker Zeitung, 21. Januar 2019.
- D. Hüttmann: Erste Losartan-Rückrufe in Deutschland, Pharmazeutische Zeitung, 2. Januar 2019.
- D. Hüttmann: Neue Verunreinigung in Losartan gefunden, Pharmazeutische Zeitung, 20. Februar 2019.
- B. Jung: Forscher identifizieren neue Sartan-Verunreinigungen, Deutsche Apotheker Zeitung, 5. Juni 2019.
- Thorsten Maybaum: Verunreinigte Blutdrucksenker: Hunderttausende Patienten betroffen, Ärzteblatt, online 6. August 2018, Abruf am 29. Aug. 2018, pdf aerzteblatt.de.
- Valsartan: EMA rechnet mit 1 Krebsfall mehr pro 5000 Patienten, Pharmazeutische Zeitung, online 3. August 2018, Abruf am 29. August 2018.
- Neue Verunreinigungen in Sartanen entdeckt apotheke adhoc, 5. Juni 2019.
- Sartan medicines: companies to review manufacturing processes to avoid presence of nitrosamine impurities, Pressemitteilung Europäische Arzneimittelagentur. Abgerufen am 25. März 2019.
- Durchführungsbeschluss der Kommission vom 2.4.2019 über die Zulassungen für Humanarzneimittel mit den Wirkstoffen „Candesartan“, „Irbesartan“, „Losartan“, „Olmesartan“ und „Valsartan“ gemäß Artikel 31 der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates (PDF; 235 kB)
- Sartane: Verunreinigungen der Wirkstoffe, Anordnung des Ruhens der Zulassung für einige sartanhaltige Arzneimittel bezüglich der Vermeidung nitrosaminhaltiger Verunreinigungen, BfArM, 2. März 2020.
- D. Moll: Sartan-Skandal: EMA veröffentlicht Grenzwerte für weitere Nitrosamine/, DAZ vom 3. September 2019.
- Temporary interim limits for NMBA, DIPNA and EIPNA impurities in sartan blood pressure medicines, EMA vom 20. August 2019 (pdf).
- Nicht nur Sartane: Antidiabetikum mit NDMA verunreinigt, DAZ.online, 29. April 2019.
- Nitrosamin-Verunreinigungen: NDMA in Ranitidin gefunden, DAZ.online, 13. September 2019.
- EMA to review ranitidine medicines following detection of NDMA, Europäische Arzneimittelagentur, 13. September 2019.
- A. Mende: Rückruf aller Ranitidin-Präparate, Pharmazeutische Zeitung, 2. April 2020.
- Vorerst keine Metformin-Rückrufe – Prüfungen laufen, DAZ.online, 5. Dezember 2019.
- Nitrosamin: EMA entwickelt Leitlinien zur Vermeidung von Nitrosaminverunreinigungen in Humanarzneimitteln, BfArM, 17. September 2019.
- EMA to provide guidance on avoiding nitrosamines in human medicines, Pressemitteilung der EMA vom 13. September 2019 (englisch)