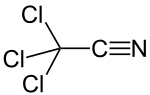
Trichloracetonitril
Trichloracetonitril (Tritox) ist eine chemische Verbindung aus der Gruppe der Nitrile. Als bifunktionelle Verbindung kann Trichloracetonitril sowohl an der Trichlormethyl- als auch an der Nitrilgruppe Reaktionen eingehen. Der elektronenanziehende Effekt der Trichlormethylgruppe aktiviert die Nitrilgruppe für nukleophile Additionen. Die hohe Reaktivität macht Trichloracetonitril zu einem vielseitigen Reagenz, bedingt aber auch seine Hydrolyseempfindlichkeit.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trichloracetonitril | ||||||||||||||||||
| Andere Namen |
Tritox | ||||||||||||||||||
| Summenformel | C2Cl3N | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbe, scharf bis ätzend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 144,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,44 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
85,7 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[3] | ||||||||||||||||||
| Brechungsindex |
1,441 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung
Die Darstellung von Trichloracetonitril durch Wasserabspaltung aus Trichloracetamid wurde erstmals 1873 von L. Bisschopinck von der Katholieke Universiteit Leuven beschrieben.[5]

Trichloracetonitril kann durch Chlorierung von Acetonitril an einem mit Zn-, Cu- und Erdalkalimetall-halogeniden imprägnierten Aktivkohle-Katalysator bei 200–400 °C in 54%iger Ausbeute erhalten werden.[6]
Die nach diesem Verfahren erforderlichen hohen Temperaturen begünstigen die Bildung von Nebenprodukten, wie z. B. Tetrachlorkohlenstoff. Dagegen führt die Chlorierung von mit Chlorwasserstoff gesättigtem Acetonitril bereits bei 50–80 °C in guten Ausbeuten zu reinem Trichloracetonitril.[7]
Wie andere halogenierte Acetonitrile entsteht Trichloracetonitril aus organischen Substanzen, wie Algen, Huminsäuren und proteinartigem Material bei der desinfizierenden Chlorierung von Wasser aus natürlichen Quellen.[8][1]
Eigenschaften
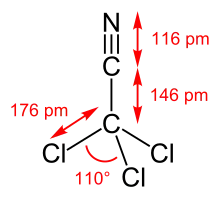
Frisch destilliertes Trichloracetonitril ist eine farblose, sich schnell gelblich bis hellbraun färbende Flüssigkeit mit stechendem Geruch, die mit Wasser, Säuren und Basen unverträglich ist.
Die Bindungslängen betragen 146,0 pm (C–C), 116,5 pm (C–N) und 176,3 pm (C–Cl). Der Bindungswinkel beträgt 110,0° (ClCCl).[9]
Verwendung
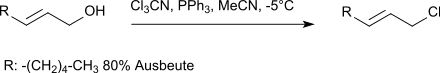
Die Substitution sämtlicher elektronegativen Substituenten im Trichloracetonitril durch nucleophilen Angriff von Alkoholat-Anionen erzeugt in hoher Ausbeute Orthokohlensäureester. Aufgrund der hohen Reaktivität der Chloratome kann Trichloracetonitril – insbesondere in Kombination mit Triphenylphosphan – zur Umwandlung von Allylalkoholen in die entsprechenden Allylchloride eingesetzt werden.[10]
Mit Carbonsäuren werden Acylchloride erhalten.[11]
Das System Cl3CCN/PPh3 eignet sich wegen der milden Reaktionsbedingungen auch für die Aktivierung von Carbonsäuren und Verknüpfung mit trägergebundenen Aminoverbindungen zu Amiden (Peptiden) in Festphasensynthesen.[12] Aus Sulfonsäuren werden analog die entsprechenden Sulfochloride gebildet.[13] In analoger Weise verläuft die Aktivierung von Diphenylphosphorsäure mit Cl3CCN/PPh3 und Umsetzung mit Alkoholen bzw. Aminen zu den entsprechenden Phosphorsäureestern bzw. -amiden in einer schonenden und effizienten Eintopfreaktion.[14]
Auch phenolische Hydroxygruppen in stickstoffhaltigen Aromaten können so in die Chlorverbindungen überführt werden.[15]

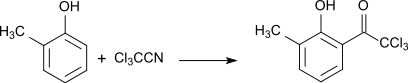
In einer Hoesch-Reaktion entstehen bei Reaktion von substituierten Phenolen mit Trichloracetonitril aromatische Hydroxyketone, z. B. aus o-Kresol das o-ständige Trichloracylderivat in 70%iger Ausbeute.[16]
Der elektronenanziehende Effekt der Trichlormethylgruppe aktiviert die Nitrilgruppe des Trichloracetonitrils gegenüber dem Angriff nucleophiler O-, N- und S-Verbindungen. So werden unter Basenkatalyse mit Alkoholen in direkter und reversibler Addition O-Alkyltrichloracetimidate gebildet,[17] die als stabile und wenig hydrolyseempfindliche Addukte isoliert werden können.
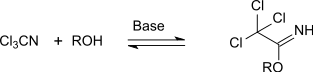
Mit primären und sekundären Aminen entstehen in glatter Reaktion mit guten Ausbeuten N-substituierte Trichloracetamidine, die durch Vakuumdestillation gereinigt werden können und als farblose, übelriechende Flüssigkeiten anfallen.[18] Die Umsetzung mit Ammoniak und anschließend mit wasserfreiem Chlorwasserstoff ergibt das feste Trichloracetamidin-Hydrochlorid, das Ausgangsverbindung für das Fungizid Etridiazol ist.
Bei der Overman-Umlagerung handelt es sich um die [3,3]-sigmatrope und diastereoselektive Umlagerung eines aus einem Allylalkohol und Trichloracetonitril unter Basenkatalyse gebildeten Trichloracetimidats in ein Allylamin. Aus Benzylalkohol und Trichloracetonitril ist auf einfache Weise Benzyltrichloracetimidat zugänglich.[19] Benzyltrichloracetimidat eignet sich als Benzylierungsreagenz für empfindliche Alkohole unter milden Bedingungen und Erhalt der Chiralität.[20]
O-Glycosyl-trichloracetimidate zur Aktivierung von Kohlenhydraten
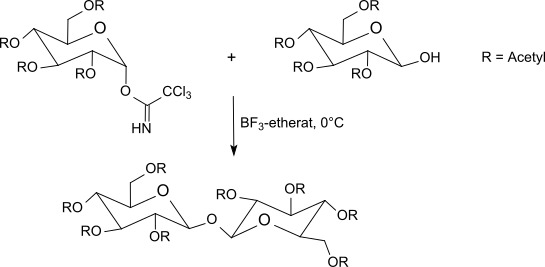
R. R. Schmidt und Mitarbeiter[21] beschrieben die selektive anomere Aktivierung von O-geschützten Hexopyranosen (Glucose, Galactose, Mannose, Glucosamin, Galactosamin) und von Hexofuranosen und Pentopyranosen mit Trichloracetonitril in Gegenwart einer Base, sowie von Glykosylierungen unter Säurekatalyse.[22][23][24]
β-Trichloracetimidate entstehen selektiv mit Kaliumcarbonat als Base unter kinetischer Kontrolle[25], während mit Natriumhydrid, Caesiumcarbonat oder Kaliumhydroxid[26] und in Gegenwart von Phasentransferkatalysatoren[27] ausschließlich α-Trichloracetimidate (thermodynamisch kontrolliert) erhalten werden.

Die meist bei −40 °C bis Raumtemperatur mit Bortrifluorid-Etherat in Methylenchlorid durchgeführte Umsetzung der Trichloracetimidate mit O-geschützten Zuckern liefert meist bessere Ergebnisse als die Koenigs-Knorr-Methode unter Verwendung von Silbersalzen oder die Helferich-Methode mit problematischen Quecksilbersalzen. Die Inversion am anomeren Zentrum führt beim Einsatz von α-Trichloracetimidaten zu β-O-Glycosiden. Die Trichloracetimidat-Methode erzeugt unter milden Reaktionsbedingungen in sehr guten Ausbeuten häufig sterisch einheitliche Glycoside.
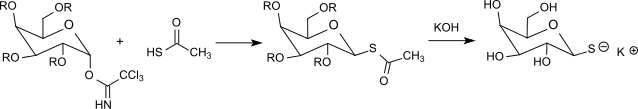
Thioessigsäure reagiert bereits ohne zusätzliche Säurekatalyse mit acetylgeschützter α-Galactosyltrichloracetimidat zum Thioglycosid, aus dem nach Abspaltung der Schutzgruppen die zur Trennung von Racematen von Aminosäuren brauchbare 1-Thio-β-D-galactose einfach zugänglich ist.[28]
In der ersten Hälfte des 20. Jahrhunderts war Trichloracetonitril ein wichtiges Begasungsmittel, heute ist es für diese Anwendung jedoch obsolet geworden.[29]
Einzelnachweise
- Frank Bernsdorff: Untersuchungen zur abiotischen Bildung von Acetonitril, Haloacetonitrilen und Trichlornitromethan. GRIN, 2007, S. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Trichloroacetonitrile, 98% bei Sigma-Aldrich, abgerufen am 22. Oktober 2013 (PDF).
- Eintrag zu Trichloracetonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Trichloroacetonitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- L. Bisschopinck, Ueber die gechlorten Acetonitrile, Ber. dt. chem. Ges., 6, (1), 731–734 (1873), doi:10.1002/cber.187300601227.
- Patentanmeldung US2375545: Process for the preparation of trichloroacetonitrile. Angemeldet am 7. Oktober 1943, veröffentlicht am 8. Mai 1945, Anmelder: Imperial Chemical Industries, Erfinder: R. T. Foster.
- Patentanmeldung US2745868: Process for the production of trichloroacetonitrile. Angemeldet am 8. Februar 1954, veröffentlicht am 15. Mai 1956, Anmelder: Deutsche Gold- und Silber-Scheideanstalt, vormals Roessler, Erfinder: G. Käbisch.
- Guidelines for Drinking Water Quality, 3. Auflage, Vol. 1, Recommendations, World Health Organization, Genf, 2004, ISBN 9-2415-4638-7, PDF.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Structure of Free Molecules in the Gas Phase, S. 9-46.
- E. D. Matveeva et al., Regioselective and stereoselective substitution of hydroxyl group for halogen in allyl alcohols, Zh. Org. Khim., 31, (8), 1121–1125 (1995).
- D. O. Jang et al., A mild and efficient procedure for the preparation of acid chlorides from carboxylic acids, Tetrahedron Lett., 40, (29), 5323–5326 (1999).
- J. Vago, J. Greiner, A useful acylation method using trichloroacetonitrile and triphenylphosphine for solid phase organic synthesis, Tetrahedron Lett., 43, (34), 6039–6041 (2002).
- O. Chantarasriwong et al., A practical and efficient method for the preparation of sulfonamides utilizing Cl3CCN/PPh3, Tetrahedron Lett., 47, (42), 7489–7492 (2006).
- A. Kasemsuknimit et al., Efficient amidation and esterification of phosphoric acid using Cl3CCN/Ph3P, Bull. Korean Chem. Soc., 32, (9), 3486–3488 (2011).
- W. Kijrungphaiboon et al., Cl3CCN/PPh3 and CBr4/PPh3: two efficient reagent systems for the preparation of N-heteroaromatic halides, Tetrahedron Lett., 53, 674–677 (2006).
- R. Martin: Aromatic Hydroxyketones: Preparation and Physical Properties. Vol. 1 Hydroxybenzophenones. 3. Auflage. Springer, 2011, ISBN 978-1-4020-9787-4, doi:10.1007/978-1-4020-9787-4.
- J. U. Nef, Ann. Chem., 287, 274 (1895).
- J. C. Grivas, A. Taurins: Reaction of trichloroacetonitrile with primary and secondary amines. In: Canadian Journal of Chemistry. 36 (5), 1958, S. 771–774, doi:10.1139/v58-113.
- F. C. Schaefer, G. A. Peters, Base-Catalyzed Reaction of Nitriles with Alcohols. A Convenient Route to Imidates and Amidine Salts, J. Org. Chem., 26, (2), 412–418, (1961), doi:10.1021/jo01061a034.
- E. P. Eckenberg et al., A useful application of benzyl trichloroacetimidate for the benzylation of alcohols, Tetrahedron, 49, 1619–1624 (1993).
- R. R. Schmidt, J. Michel, Einfache Synthese von α- und β-O-Glycosylimidaten. Herstellung von Glykosiden und Disacchariden, Angew. Chem., 92, 763–764 (1980).
- R. R. Schmidt, Neue Methoden zur Glycosid- und Oligosaccharidsynthese – gibt es Alternativen zur Koenigs-Knorr-Methode?, Angew. Chem. 98, 213–236 (1986).
- R. R. Schmidt, W. Kinzy, Anomeric-oxygen activation for glycoside synthesis – the trichloroacetimidate method, Adv. Carbohydr. Chem. Biochem., 50, 21–123 (1994).
- R. R. Schmidt, K.-H. Jung, Oligosaccharide synthesis with trichloroacetimidates, In: Preparative Carbohydrate Chemistry, S. Hanessian, Ed., Marcel Dekker, New York, 283–312 (1997), ISBN 0-8247-9802-3.
- R. R. Schmidt, J. Michel, Liebigs Ann. Chem., 1343–1357 (1984).
- F. J. Urban et al., Tetrahedron Lett., 31, 4421–4424 (1990)
- V. J. Patil, Tetrahedron Lett., 37, 1481–1484 (1996).
- A. Jegorov et al., 1-Thio-β-D-galactose as a chiral derivatization agent fort he resolution of D,L-aminoacid enantiomers, J. Chromatogr. A, 673(2), 286–290 (1994).
- N. M. Sax, R. J. Lewis, Hawley's Condensed Chemical Dictionary, 11th ed., Van Nostrand Reinhold, New York, S. 261, 1175 (1987).

