Overman-Umlagerung
Die Overman-Umlagerung ist eine Namensreaktion der Organischen Chemie, die nach ihrem Entdecker dem US-amerikanischen Chemiker Larry E. Overman (* 1943) benannt wurde. Die Overman-Umlagerung ist eine Variante der Claisen-Umlagerung.[1][2]
Übersichtsreaktion
Durch die atomökonomische Umsetzung eines Allylalkohols mit Natriumhydrid und Trichloracetonitril entsteht ein N-Allylamid, im Beispiel ein Trichloressigsäureamid:[3]
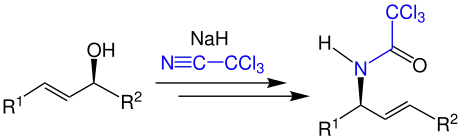
Reaktionsmechanismus
Im ersten Schritt wird die Hydroxygruppe des Allylalkohols 1 durch ein aus dem Natriumhydrid generiertes Hydridanion deprotoniert, wobei unter Freisetzung von Wasserstoff das Alkoholat 2 entsteht. Das Kohlenstoffatom des Trichloracetonitrils ist partiell positiv polarisiert und wird darum vom formal negativ geladenen Alkoholat 2 angegriffen. Das entstandene Nitrid 3 wird durch ein neues Allylalkoholmolekül protoniert:
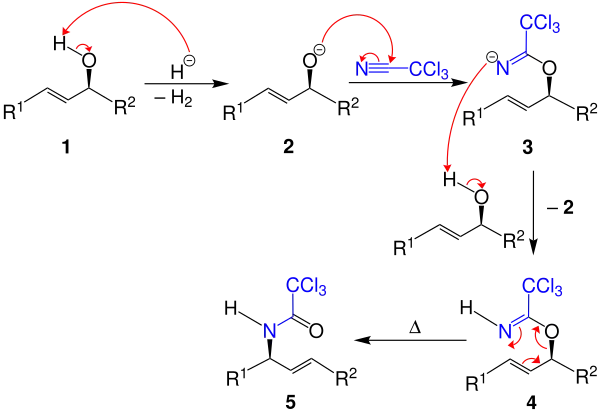
Dadurch entsteht das Trichloracetimidat 4 unter Bildung eines neuen Alkoholats 2, der Katalysecyclus ist damit geschlossen. Diese diastereoselektive Umlagerung wird in der Hitze durch Quecksilber(II)- oder Palladium(II)-Salze katalysiert. Anschließend kann durch Erhitzen die Claisen-Umlagerung erfolgen, wobei das Trichloressigsäureamid 5 entsteht. Die Reaktion kann ebenso enantioselektiv mit chiralen Auxiliar katalysiert werden.[4][5]
Praktische Bedeutung
Allylamin-Derivate können zur Herstellung bedeutender, biologischen Verbindungen verwendet werden.[6][7] So können sie als Basismonomere für Polyallylamin-Verbindungen dienen. Diese werden benötigt, um den Arzneistoff Sevelamer produzieren zu können. Sevelamer wird unter anderem benötigt, um eine Erhöhung des Phosphatspiegels im Blut zu behandeln. Allylamin ist außerdem ein Baustein zur Synthese eines Fungizids.
Literatur
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism.Vol 1.Springer 2002. ISBN 3-540-43024-5.
- T. Nishikawa, M. Asai, N. Ohyabu, M. Isobe:Improved Conditions for Facile Overman Rearrangement, in: J. Org. Chem. 1998, 63 (1), 188–192; PMID 11674062.
- T. Allmendinger, E. Felder, E. Hungerbühler, in: Tetrahedron Lett. 1990, 31, 7301–7304.
Einzelnachweise
- L. E. Overman: "Thermal and mercuric ion catalyzed [3,3]-sigmatropic rearrangement of allylic trichloroacetimidates. 1,3 Transposition of alcohol and amine functions", in: J. Am. Chem. Soc. 1974, 96 (2), 597–599; doi:10.1021/ja00809a054.
- Lane A. Clizbe, L. E. Overman: Allylically transposed Amines from Allylic Alcohols: 3,7-Dimethyl-1,6-Octadien-3-Amine In: Organic Syntheses. 58, 1978, S. 4, doi:10.15227/orgsyn.058.0004; Coll. Vol. 6, 1988, S. 507 (PDF).
- L. E. Overman: "Allylic and propargylic imidic esters in organic synthesis", in: Accounts of Chemical Research 1980, 13 (7), 218–224; doi:10.1021/ar50151a005.
- C. E. Anderson, L. E. Overman: "Catalytic Asymmetric Rearrangement of Allylic Trichloroacetimidates. A Practical Method for Preparing Allylic Amines and Congeners of High Enantiomeric Purity", in: J. Am. Chem. Soc. 2003, 125 (41), 12412–12413; doi:10.1021/ja037086r.
- Carolyn E. Anderson, Larry E. Overman, and Mary P. Watson: Asymmetric Overman Rearrangement In: Organic Syntheses. 82, 2005, S. 134, doi:10.15227/orgsyn.082.0134 (PDF).
- L. E. Overman: "A general method for the synthesis of amines by the rearrangement of allylic trichloroacetimidates. 1,3 Transposition of alcohol and amine functions", in: J. Am. Chem. Soc. 1976, 98 (10), 2901–2910; doi:10.1021/ja00426a038.
- Y. K. Chen, A. E. Lurain, P. J. Walsh: "A General, Highly Enantioselective Method for the Synthesis of D and L α-Amino Acids and Allylic Amines", in: J. Am. Chem. Soc. 2002, 124 (41), 12225–12231; doi:10.1021/ja027271p.