Trichlormethansulfenylchlorid
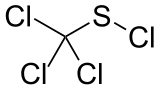
Trichlormethansulfenylchlorid ist eine stark giftige chemische Verbindung mit der Summenformel CCl4S.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trichlormethansulfenylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CCl4S | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche, ölige, übelriechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 185,89 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,69 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
147–149 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,5395[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,8 mg·m−3[3] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung und Gewinnung
Die Verbindung kann aus der Reaktion von Kohlenstoffdisulfid mit molekularem Chlor in Gegenwart von Iod[9] oder Chlorwasserstoff[10] hergestellt werden. Weitere Synthesemöglichkeiten bestehen in der Chlorierung von Dimethylsulfid[11] oder von Thiophosgen.[12][13]
Eigenschaften
Trichlormethansulfenylchlorid ist eine übelriechende, toxische Flüssigkeit, die bei 147–149 °C siedet. In Benzol besitzt sie ein Dipolmoment von 0,65 D.[14]
Verwendung
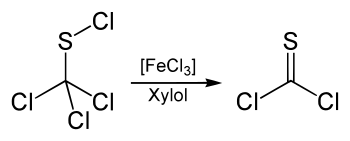
Die Substanz kann zur Synthese von Thiophosgen benutzt werden. Hierzu wird sie mit Eisen(III)-chlorid-Katalysator bei 140 °C in Xylol umgesetzt.[15]
Trichlormethansulfenylchlorid wurde unter dem Decknamen „Clairsite“ von französischen und russischen Streitkräften im Ersten Weltkrieg als chemischer Kampfstoff eingesetzt.[16]
Durch einen Chlor-Fluor-Austausch mittels Quecksilber(II)-fluorid oder Silber(I)-fluorid kann das Dichlorfluormethylsulfenylchlorid erhalten werden,[17][18] welches für die Herstellung der Fungizide Dichlofluanid und Tolylfluanid benötigt wird.
Sicherheitshinweise
Trichlormethansulfenylchlorid kann sowohl über die Atemwege als auch dermal oder oral aufgenommen werden. Dabei reizt es Augen, Rachen, Bronchien und Alveolen. Im menschlichen Organismus erzeugt es Leber- und Nierenschäden.[19] Beim Tierversuch mit Ratten[7][8] und Mäusen[4][6] zeigte sich inhalativ und oral eine hohe Toxizität mit Symptomen wie Durchfall, Hautreizungen und -veränderungen sowie Atemnot.[5]
Einzelnachweise
- Eintrag zu Trichlormethylsulfenylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- I. B. Douglass, F. T. Martin, R. Addor: Sulfenyl Chloride studies. II. Mono-, Di-, and Tri-Chloromethanesulfenyl Chlorides and Certain of their Derivatives, in: J. Org. Chem., 1951, 16, S. 1297–1302, doi:10.1021/jo50002a018.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 594-42-3 bzw. Trichlormethansulfenylchlorid), abgerufen am 2. November 2015.
- Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure, Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, S. 97, 1982.
- Eintrag zu Trichloromethanesulfenyl chloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- National Technical Information Service. Vol. OTS0533569.
- Toxicology and Applied Pharmacology. Vol. 42, S. 417, 1977.
- Sbornik Vysledku Toxixologickeho Vysetreni Latek A Pripravku, Marhold, J.V., Institut Pro Vychovu Vedoucicn Pracovniku Chemickeho Prumyclu Praha, Czechoslovakia, S. 13, 1972.
- W. Autenrieth, H. Hefner: Über Versuche mit Thiophosgen, in: Chem. Ber., 1925, 58, S. 2151–2156, doi:10.1002/cber.19250580935.
- G.K.S. Prakash, J. Hu, J. Simon, D.R. Bellew, G.A. Olah: Preparation of α,α-difluoroalkanesulfonic acids in J. Fluorine Chem., 2004, 125, 595–602, doi:10.1016/j.jfluchem.2003.11.031.
- Patent Schering DE 416603.
- J.W. James: The action of chlorine on organic thiocyanates. Part I. Methyl thiocyanate in J. Chem. Soc., 1887, 51, 268–274, doi:10.1039/CT8875100268.
- P. Klason: Ueber einige schwefelhaltige Derivate des Kohlensäureesters in Chem. Ber., 1887, 20, 2384–2385, doi:10.1002/cber.18870200256.
- M. T. Rogers and K. J. Gross: The Electric Moments of Some Sulfur and Selenium Compounds, in: J. Am. Chem. Soc., 1952, 74, S. 5294–5296, doi:10.1021/ja01141a018.
- E. F. Orwoll, US-Patent 2668853.
- A. T. Schäfer: Lexikon biologischer und chemischer Kampfstoffe. Köster, Berlin, 2003. (ISBN 3-89574-515-4).
- Kober, E.: A New Class of Sulfenyl Derivatives; Perhalogenated Aliphatic Sulfenyl Fluorides in J. Am. Chem. Soc. 81 (1959) 4810–4812, doi:10.1021/ja01527a016.
- Ham, N.S.: Dichlorofluoromethanesulfenyl chloride in J. Am. Chem. Soc. 83 (1961) 751–752, doi:10.1021/ja01464a052.
- Jürgen Fritze: Die ärztliche Begutachtung: Rechtsfragen, Funktionsprüfungen, Beurteilungen. 7. Auflage, Springer, 2008, ISBN 978-3-7985-1563-5, S. 296.

