Carbonylfluorid
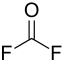
Carbonylfluorid ist die gebräuchlichste Bezeichnung für Kohlenoxiddifluorid, CF2O, das Difluorid der Kohlensäure. Es ist das Fluor-Analogon des Phosgens.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Carbonylfluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CF2O | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, hygroskopisches Gas mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 66,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−84,6 °C[1] | ||||||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 2 ml·m−3 bzw. 5 mg·m−3[3] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−639,8 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Carbonylfluorid ist ein giftiges, stechend riechendes Gas, das aufgrund seiner Hygroskopie an der Luft raucht. Es ist gut in organischen Lösungsmitteln löslich (beispielsweise Benzol, Toluol, Chlorbenzolen und anderen), es löst sich in Wasser unter rascher Zersetzung zu Kohlenstoffdioxid und Flusssäure, weshalb die organischen Lösemittel wasserfrei gemacht werden müssen, sollen diese zur Synthese oder zum Arbeiten mit Carbonylfluorid verwendet werden:
Darstellung
Carbonylfluorid entsteht meist als Zersetzungsprodukt fluorierter Kohlenwasserstoffe bei deren thermischer Zersetzung, beispielsweise aus Trifluormethanol oder Tetrafluormethan unter Anwesenheit von Wasser:
Es kann auch aus Kohlenstoffmonoxid und Fluor synthetisiert werden:[5]
Im Labor erfolgt die Darstellung reinen Carbonylfluorids durch die Umsetzung von Kohlenstoffmonoxid mit Silber(II)-fluorid in einem Kupferrohr[6]:
Verwendung
Im Labormaßstab kann Carbonylfluorid für Fluor-Synthesen verwendet werden, da es sehr leicht unter Abgabe der Fluoratome Sauerstoff aufnimmt und zu Kohlenstoffdioxid weiter reagiert.
Toxische Wirkung
Carbonylfluorid reizt bei inhalativer Aufnahme Haut, Augen und Atemwege. An Augen und Haut kommt es zu Schmerzen, Rötungen, schweren Verbrennungen und Sehbeeinträchtigungen durch Entziehen des Wassers aus dem Gewebe und zusätzlich durch den entstehenden Fluorwasserstoff. Carbonylfluorid bildet mit Körperflüssigkeiten Fluorwasserstoffsäure, was die ätzende und giftige Wirkung erklärt. Bei einem Kontakt mit flüssigem Carbonylfluorid entstehen Erfrierungen. Nach längerer Aufnahme durch die Atemwege zeigt der Patient Halsschmerzen, Husten und Dyspnoe. Die Symptome können verzögert auftreten. Als schlimmste inhalatorische Folge kann ein toxisches Lungenödem auftreten. Dieses ist mit Cortison, auf jeden Fall auch präklinisch, zu therapieren.
Die Toxizität von Carbonylfluorid wird hauptsächlich durch Hydrolyse mit nachfolgender Flusssäure-Vergiftung erklärt, jedoch deuten Tierversuche auf eine höhere Toxizität im Vergleich zu gasförmigem Fluorwasserstoff hin.[7] Dies könnte an einer größeren Eindringtiefe in die Atemwege liegen. Direkte Reaktion mit Biomolekülen, wie sie bei Phosgen für dessen Giftigkeit maßgeblich sind, scheinen bei COF2 eine untergeordnete Rolle zu spielen, da sich dieses bei Kontakt mit Feuchtigkeit viel schneller zersetzt. Dieser Umstand und die damit verbundene stärkere Reizwirkung (Warnung) könnten die geringere Toxizität von Carbonylfluorid im Vergleich zu Phosgen erklären. Insgesamt gibt es wesentlich weniger toxikologische Daten über Carbonylfluorid als über Phosgen, und die letalen Dosen weichen in unterschiedlichen Studien zum Teil erheblich auseinander.[8]
Einzelnachweise
- Eintrag zu Carbonyldifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Otto Ruff, Gustav Miltschitzky: Das Kohlenoxyfluorid COF2. In: Zeitschrift für anorganische und allgemeine Chemie. 221, 1934, S. 154-158, doi:10.1002/zaac.19342210207.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 353-50-4 bzw. Carbonylfluorid), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 206–208.
- M. W. Farlow et al.: Carbonyl fluoride. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 155–158 (englisch).
- Adolph J. Januszkiewicz, Matthew A. Bazar, Lee C. B. Crouse, Michael A. Chapman, Steven E. Hodges, Steven J. McCormick, Arthur J. O’Neill: Morbidity and mortality resulting from acute inhalation exposures to hydrogen fluoride and carbonyl fluoride in rats. In: Inhalation Toxicology. Band 30, Nr. 3, 2018, S. 114–123, doi:10.1080/08958378.2018.1465494.
- Acute Exposure Guideline Levels for Selected Airborne Chemicals: Volume 18 – Chapter: 2 Carbonyl Fluoride, 2014.


