Hiyama-Kupplung
Die Hiyama-Kupplung ist eine Namensreaktion der organischen Chemie, die 1988 von den japanischen Chemikern Tamejiro Hiyama (* 1946) und Yasuo Hatanaka entdeckt wurde. Es handelt sich um eine Palladium-katalysierte Kreuzkupplungsreaktion, bei der ein Aryl-, Alkyl- oder Vinylhalogenid mit einem Organosilan unter Knüpfung einer C-C-Bindung umgesetzt wird.[1]
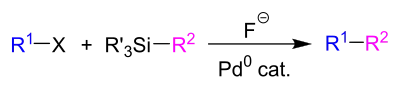
Bei dem Rest X handelt es sich in der Regel um die Halogenide Chlorid (Cl), Bromid (Br) oder Iodid (I), aber auch andere Abgangsgruppen wie Triflat (OTf) sind möglich. Bei den Resten R' am Siliciumatom kann es sich um Fluorid oder Chlorid, aber auch um andere Alkylreste oder Alkoxygruppen handeln. Als Fluoridquelle kann beispielsweise Tetrabutylammoniumfluorid (TBAF) in stöchiometrischen Mengen[2] und als Palladiumquelle zum Beispiel Palladium(II)-acetat (Pd(OAc)2) oder Tris(dibenzylidenaceton)dipalladium(0) (Pd2(dba)3) in katalytischen Mengen[2] dienen.
Reaktionsmechanismus
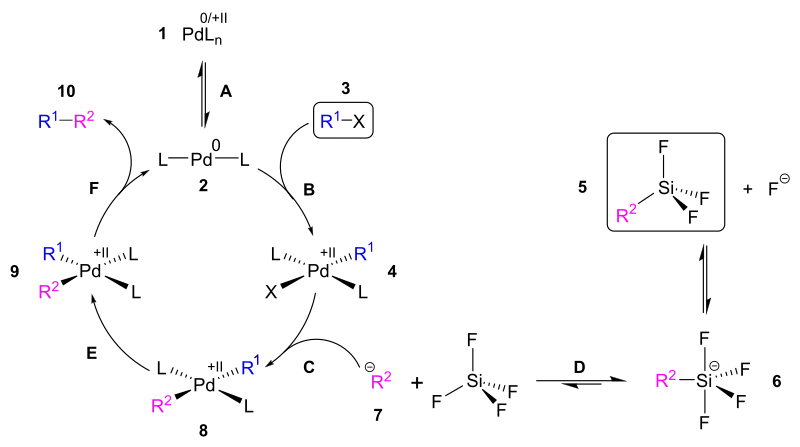
Der Reaktionsmechanismus der Hiyama-Kupplung ist ähnlich zu dem anderer Kreuzkupplungsreaktionen, wie zum Beispiel die Suzuki-Kupplung oder die Negishi-Kupplung. Der wesentliche Punkt des Mechanismus ist ein Katalysezyklus, der im Folgenden beispielhaft mit einer Trifluorsilylsubstituierten Verbindung (R2–SiF3) dargestellt wird.[3]
Der Katalysezyklus beginnt mit dem katalytisch aktiven, zweifach koordinierten Pd0-Komplex 2. Da dieser nicht direkt eingesetzt werden kann, muss er zunächst in situ aus einem Präkatalysator 1 dargestellt werden. Dies erfolgt durch die Gleichgewichtsreaktion A, welche gelegentlich, je nach eingesetzter Verbindung, erst nach Zugabe eines weiteren Liganden (zum Beispiel Triphenylphosphin (PPh3)) abläuft. Als nächstes erfolgt eine oxidative Addition (B) des als Edukt eingesetzten Halogenids 3. Dabei entsteht ein vierfach koordinierter PdII-Komplex, der zunächst cis-substituiert ist, jedoch in der Regel rasch zum trans-Komplex 4 isomerisiert.[4] Bevor der nächste Schritt des Zyklus erfolgt, muss der Reaktionspartner dieses Schrittes generiert werden. Dies erfolgt, indem an die hier als Edukt eingesetzte Trifluorsilylverbindung 5 ein Fluorid addiert wird, wobei ein negativ geladenes, pentavalentes Silicium-Intermediat 6 entsteht. Aufgrund des chemischen Gleichgewichtes D ist stets eine geringe Menge des R2-Anions 7 vorhanden, welches in den Katalysezyklus eintreten kann. Es kommt zu einer Ligandensubstitution (C), bei dem der Halogenid-Ligand durch den Rest R2 ausgetauscht wird (8). Die ursprüngliche C-Si-Bindung (R2-Si) ist nun eine C-Pd-Bindung (R2-Pd), somit hat eine Transmetallierung stattgefunden. Nach einer cis-trans-Isomerisierung (E) kann am Komplex 9 eine reduktive Eliminierung (F) erfolgen, bei dem das Kupplungsprodukt 10 und erneut der aktive Katalysator 2 entstehen.
Hiyama-Denmark-Kupplung
Eine Variante der Reaktion, die unter fluoridfreien Bedingungen abläuft, ist die nach Hiyama und Scott Denmark benannte Hiyama-Denmark-Kupplung. Dabei wird als Kupplungspartner ein Organosilanol verwendet. Statt Fluorid kann zur Aktivierung dieser Verbindung eine Brønstedt-Base verwendet werden.[5]
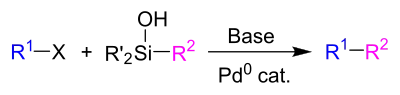
Mechanistisch verläuft diese Reaktion ähnlich wie die Fluorid-aktivierte Standardvariante der Kupplung. Die Aktivierung erfolgt hier jedoch durch Deprotonierung des Silanols unter Ausbildung des Silanolats, welches statt des R2-Anions an das Pd-Zentrum unter Ausbildung einer Pd-O-Bindung koordiniert. Anschließend koordiniert der zu kuppelnde Rest R2 an das Palladium-Zentrum, wobei das Silanon R'2Si=O eliminiert wird, welches sofort mit einem weiteren Äquivalent zu einem Siloxan reagiert.[5]
Literatur
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Jr., Name Reactions and Reagents in Organic Synthesis, John Wiley, Hoboken (N.J.) 2005, ISBN 0-471-22854-0, S. 320–321.
- Cristina Mateo, Carolina Fernández-Rivas, Antonio M. Echavarren, Diego J. Cárdenas, Isolation of the Transmetalation Step in the Hiyama Cross-Coupling Reaction of Organosilanes. In: Organometallics 16, 1997, 1997–1999.
Einzelnachweise
- Yasuo Hatanaka, Tamejiro Hiyama: Cross-coupling of organosilanes with organic halides mediated by a palladium catalyst and tris(diethylamino)sulfonium difluorotrimethylsilicate. In: Journal of Organic Chemistry 53, 1988, 918–920, doi:10.1021/jo00239a056.
- Shaundra Riggleman, Philip DeShong: Application of Silicon-Based Cross-Coupling Technology to Triflates. In: Journal of Organic Chemistry 68, 2003, 8106–8109, doi:10.1021/jo034809g.
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Jr.: Name Reactions and Reagents in Organic Synthesis. John Wiley, Hoboken (N.J.) 2005, ISBN 0-471-22854-0, S. 320–321.
- Arturo L. Casado, Pablo Espinet: On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4 and the Mechanism of the cis-to-trans Isomerization of [PdRX(PPh3)2] Complexes (R = Aryl, X = Halide). In: Organometallics 17, 1998, 954–959, doi:10.1021/om9709502.
- Scott E. Denmark, Christopher S. Regens: Palladium-Catalyzed Cross-Coupling Reactions of Organosilanols and their Salts. In: Accounts of Chemical Research 41, 2008, 1486–1499, doi:10.1021/ar800037p.